Título
Abordajes Quirúrgicos al Tercer Ventrículo
Segunda parte: Vías de abordaje
Segunda parte: Vías de abordaje
Autor
R. Mormandi
Fecha
Junio 1997
Lugar de Realización
Instituto de Neurocirugía y Neurología "Prof. Dr. Enrique Pardal" Sanatorio Mitre, Buenos Aires
Texto
Revista Argentina de Neurocirugía 11: 73, 1997
Actualización
Abordajes Quirúrgicos al Tercer Ventrículo
Segunda parte: Vías de abordaje
R. Mormandi
Instituto de Neurocirugía y Neurología "Prof. Dr. Enrique Pardal" Sanatorio Mitre, Buenos Aires
Correspondencia: Terrada 2785 (1417) Buenos Aires
RESUMEN
La entrada a la cavidad del tercer ventrículo implica la sección de elementos nerviosos y / o vasculares cuya ubicación, relaciones anatómicas y función se deben conocer a la hora de decidir la vía de abordaje con el fin de adecuar y optimizar la táctica quirúrgica que posibilite reducir los riesgos inherentes de la vía elegida.
En el presente trabajo se revisa y actualiza la bilbiografia existente sobre los abordajes quirúrgicos al tercer ventrículo. Se presenta una nueva clasificación sobre abordajes y vías de abordaje al tercer ventrículo basado en la localización de la lesión y a la pared del tercer ventrículo implicada en el abordaje. Así, los mismos pueden ser a través de la pared anteroinferior, techo y pared posterior.
Palabras clave: abordaje microquirúrgico, microneurocirugía, tercer ventrículo
ABSTRACT
The access to the third ventricular chamber implies the section of vascular and neural structures, whose location, anatomic relations and functions should be known at the time of choosing the apropiate operative route in order to adecuate the surgical tactic that allows to reduce the inherent rísks of the chosen approach.
The bibliography about surgical approaches of the third ventricle is reviewed and updated. A new clasification about approaches and operative routes to the third ventricle, based on the location of the lesion and the wall of the third ventricle implied in the approach, is introduced. They may be done out through the anteroinferior wall, the roof and the posterior wall.
Key words: microneurosurgery, microsurgical approach, third ventricle.
INTRODUCCIÓN
El abordaje al TV implica algún tipo de daño a la corteza cerebral, cuerpo calloso o pared ventricular, el riesgo de lesión de estructuras vasculares puede conducir a secuelas neurológicas transitorias o definitivas con una implicancia médicosocial importante.
La manipulación de las paredes ventriculares pueden causar disfunción hipotalámica provocando alteraciones en la regulación térmica, nivel de conciencia, respiración, manejo hidroelectrolítico, regulación hormonal y memoria, entre otros, Los trastornos visuales pueden deberse a lesiones sobre la vía óptica (nervio óptico, quiasma, cintilla., cuerpo geniculado, corteza cerebral o tercio posterior del cuerpo calloso). Los movimientos extraoculares se alteran con las lesiones en la pared posterior del TV. Las lesiones forniceales (bilaterales generalmente) se traducirán en trastornos de la memoria reciente. Las callosotomías conducirán a trastornos de la transferencia interhemisférica de información provocando un síndrome de desconexión. caracterizado por trastornos intelectuales (apatía, hipoquinesia, hipomnesia de tipo reciente); motores (apraxia ideomotriz); sensitivos (estereoagnosia) y sensoriales (agnosia visual16,21. El manejo de la corteza cerebral mediante incisión o retracción puede provocar contusiones, atrofia, infarto, porencefalia, traduciéndose en hemiparesia, convulsiones, trastornos de la conciencia, mutismo y defectos visuales.
De las lesiones arteriales, las que implican el sector anterior del polígono de Willis provocarán trastornos de memoria y personalidad; en cambio las que impliquen el sector posterior provocarán trastornos del nivel de conciencia y de los movimientos extraoculares. Las lesiones venosas dan déficit inconstantes pero no por ello dejan de ser importantes; la ligadura de la vGa es incompatible con la vida, generalmente. Esa inconstancia se debe probablemente a la diferente anatomía venosa de los pacientes, sistemas colaterales de drenaje y cantidad de anastomosis. La oclusión de la vCi o vTE puede cursar en forma asintomática o provocar somnolencia, hemiplejia o mutismo por infarto de los ganglios de la base.
La patología del TV es la que presenta mayor dificultad de exposición y exéresis quirúrgica. Apuzzo3 valiéndose de la tomografía computada, resonancia nuclear magnética y a veces de la angiografía cerebral clasifica a los procesos patológicos del TV en:
- Extraaxial intraventricular: de histología benigna con algunas áreas de adherencias a la pared ventricular. Son ejemplos el quiste coloideo, cisticercosis.
- Intraaxial con componente ventricular: son los tumores o malformaciones de las paredes con expresión hacia la luz ventricular. Por ejemplo: glioma, de tálamo.
- Basal: son los tumores de base de cráneo, selares-supraselares con expansión rostral hacia el TV. Si hay disrupción del piso será intra y extraventricular El ejemplo típico es el craneofaringioma.
Esta clasificación topográfica es importante para el diseño de la vía de abordaje, aunque no solo la topografía debe pesar sobre la elección de la misma sino además el tipo de lesión, presencia de hidrocefalia y cuadro clínico y neurológico.
Una amplia variedad de lesiones se originan en o secundariamente aparecen en el TV. Genéricamente se los divide en: tumorales: gliomas, germinomas, metástasis, craneofaringiomas, adenomas hipofisiarios, papiloma y carcinoma de plexo coroideo, meningiomas, tumores de la región pineal; vasculares: aneurismas, malformaciones arteriovenosas. cavernomas; infecciosas: abscesos, tuberculomas. cisticercosis y misceláneas: quiste coloideo, dermoideos, epidermoideos, ependimarios, aracnoideos, sarcoidosis. Los ependimomas originados del manto ependimario, los subependimomas y astrocitomas del tejido glial subyacente son tumores relativamente frecuentes y su evolución dependerá del grado de malignidad y localización.
Los craneofaringiomas son tumores de la región supraselar con invasión secundaria al TV. Los craneofaringiomas intraventriculares puros se originan probablemente de restos celulares de la eminencia media2.
Los adenomas hipofisiarios son tumores que en su crecimiento rostral comprometen la pared anteroinferior del TV.
Los meningiomas derivados de células aracnoidales, se desarrollan a partir de la tela coroidea. Son más frecuentes a nivel del atrio ventricular que en el TV, y en general los intraventriculares son más frecuentes en niños que en adultos34.
Los papilomas de los plexos coroideos se originan principalmente en el TV y se caracterizan por la hidrocefalia que producen. Esta puede ser obstructiva (por bloqueo del agujero de Monro) y/
o comunicante (por hipersecreción de LCR o hiperproteinorraquia)39,40.
Los tumores de la región pineal son generalmente malignos y están asociados a hidrocefalia por bloqueo del acueducto de Silvio.
La patología vascular no es tan frecuente aunque no deja de ser interesante. Recientemente se han publicado casos de aneurismas del tope de la aB con impronta o penetración en el piso del TV que se operaron por vía transcallosa o transventricular pasando por el TV1,9,12. Los cavernomas y malformaciones arteriovenosas puros del TV son poco frecuentes23.
La neurocisticercosis se caracteriza por quistes intracerebrales o intraventriculares que pueden migrar y crecer adheridos en alguna pared ventricular.
Los abscesos piógenos se desarrollan en general en el tálamo.
El quiste coloideo representa el clásico tumor benigno de la región y se origina de restos celulares de la parafisis, glándula rudimentaria que involuciona en el cuarto mes de vida fetal. Se localiza generalmente adherido a la tela coroidea del techo por detrás del agujero de Monro, contiene un material mucinoso con células epiteliales descamadas, eritrocitos, leucocitos y pigmento colesterínico. Debido a su localización y efectos mecánicos secundarios (pueden obstruir intermitentemente el agujero de Monro) representa una verdadera amenaza para la vida, por lo que siempre tienen indicación quirúrgica.
Los quistes ependimarios y aracnoideos contienen LCR y se diferencian por su localización; los primeros son intraventriculares y recubiertos por ependimocitos; en cambio, los segundos se originan en el velum interpositum y están cubiertos por aracnoides.
La hidrocefalia es una complicación que puede existir tanto en el pre como en el postoperatorio. La misma se debe al bloqueo del acueducto de Silvio o de los agujeros de Monro.
ABORDAJES Y VÍAS DE ABORDAJE AL TERCER VENTRÍCULO
Existen numerosos abordajes al interior o alguna de las paredes del TV. Es necesario aclarar ciertos aspectos en la terminología. La ruta o vía de abordaje comprende a todos los pasos y maniobras necesarias para llegar a una región determinada. Por ejemplo la vía de abordaje subfrontal. En cambio el abordaje específico implica los pasos y maniobras necesarias dentro de una región determinada. Por ejemplo el abordaje subquiasmático. Resumiendo, para llegar al espacio subquiasmático es necesario utilizar una vía de abordaje subfrontal y luego un abordaje subquiasmático.
En la Tabla 1 se describe la clasificación propuesta de abordajes al TV. Nótese que la celda correspondiente de los abordajes a través de la pared posterior está ausente, debido a que los mismos están dirigidos prácticamente a la región pineal por lo que solamente cambian las vías de abordaje. Completa esta clasificación un esquema sobre la indicación de los abordajes de acuerdo a las posibles localizaciones de los tumores en una vista sagital del TV (Fig. 5).

Fig. 5. Indicación de los abordajes de acuerdo a las posibles localizaciones de las lesiones en una vista sagital del TV.
Tabla 1. Clasificación de abordajes al tercer ventrículo

La elección del abordaje y vía de abordaje dependerá del cuadro clínico y neurológico, localización de la lesión tomando en cuenta su origen y proyección a estructuras vecinas, adherencias o puntos de contacto en alguna pared, presencia de hidrocefalia uni o biventricular y tipo de lesión; en caso de malformaciones vasculares es preferible abordarlas desde el pedículo nutricio; quizás existan más elementos que inclinen la balanza hacia alguna vía en especial, pero es aveces la experiencia del cirujano y la familiaridad con un a determinada vía de abordaje lo que hace tener más peso en la elección "acertadamente o no".
Frecuentemente se emplean dos o tres abordajes específicos por la misma vía de abordaje; por ejemplo, los abordajes subquiasmático, interóptico-carotídeo y carótido-tentorial a través de una vía de abordaje frontotemporal. Menos frecuente en su utilización es el abordaje combinado donde se emplean dos o más vías de abordaje mediante dos craneotomías generalmente simultáneas. Por ejemplo, con el abordaje transcalloso transforaminal las porciones de tumor debajo de la lámina terminalis y quiasma pueden ser no visibles; y al combinar esta vía de abordaje con una frontotemporal las porciones ocultas o ciegas dejarían de serlo. Los craneofaringiomas intra y extraventriculares son el ejemplo típico y más frecuente de cirugías con abordajes combinados, modalidad aconsejada por Yasargil y colaboradores59.
Existen una serie de maniobras básicas en neurocirugía que bien vale la pena recordar37:
• La retracción cerebral debe ser mínima. Debe tenerse en cuenta cuando alguna de las paredes de la vía elegida está fija: piso de la fosa anterior, media, posterior y la hoz del cerebro. Así, las craneotomías deben ser basales en las vías subfrontal, frontotemporal y subtemporal; o llegar al borde y exponer los senos venosos en las vías interhemisféricas, occipital transtentorial y supracerebeloso infratentorial.
• La incisión sobre tejido nervioso debe ser mínima. Son ejemplos la corteza cerebral, cuerpo calloso, etc.
• La ligadura de arterias y venas debe ser mínima. Numerosos elementos vasculares se observan en las diferentes vías desde la duramadre hasta el TV, por lo que el cirujano debe reconocerlos y seccionar lo mínimo posible.
• Vaciamiento intracapsular versus resección en bloque. En los tumores profundos se debe hacer primero un vaciamiento y luego la exéresis de la cápsula. El espacio se gana con el vaciamiento y no con la retracción innecesaria de tejido cerebral.
• La circulación de LCR debe estar asegurada. La hidrocefalia es una complicación que puede aparecer, incluso, en el postoperatorio. Aveces, es suficiente una apertura en la pared anterior, piso o posterior del TV de acuerdo a la cirugía; otras veces se puede reasegurar la tercerventriculostomía interna con un tubo de Silastic al espacio subaracnoideo regional o cisterna magna creando una derivación de Torkildsen modificada, o bien se puede dejar una ventriculostomía externa transitoria.
A) Abordajes a través de la pared anteroinferior
Son utilizados en las lesiones de la región selar, supraselar, paraquiasmática y que comprometen secundariamente al TV. Las lesiones más frecuentes son los tumores hipofisarios en los adultos y los craneofaringiomas en los niños. Clínicamente se presentan con déficit visual, disfunción hipotálamo-hipofisiaria y disturbios mentales.
Las diferentes vías de abordaje y ángulos de entrada a la pared anteroinferior se observan en la Fig. 6.

Fig. 6. Vías de abordaje y los ángulos de entrada a la pared anteroinferior del TV. A. Vista axial. B, Vista sagital
A la pared anteroinferior del TV y regiones vecinas se puede llegar desde un ángulo anterior, anterolateral y lateral, Con un ángulo anterior se puede abordar la pared anteroinferior del TV, los espacios interóptico-quiasmático e interópticocarotídeo, la región selar-supraselar y el seno esfenoidal. Las vías de abordaje que siguen una vista o ángulo anterior son la vía transeptoesfenoidal y la subfrontal.
La vía transeptoesfenoidal está indicada en todos los tumores de la región selar y supraselar que comprometan la pared anteroinferior del TV respetando las siguientes condiciones: el eje mayor del tumor debe coincidir con el eje de la vía de abordaje, la silla turca debe estar agrandada y el seno esfenoidal neumatizado u ocupado por tumor17,37,51, La exéresis tumoral está limitada al vaciamiento intracapsular, y en el caso que la cápsula descienda al campo operatorio la disección de la misma de estructuras neurovasculares no se realiza bajo visión directa, Las posibles complicaciones de la vía son: defecto cosmético nasolabial, insuficiencia ventilatoria nasal, lesión del nervio infraorbitario y de la mucosa olfatoria, fractura de base de cráneo, lesión de los pares craneanos del 1 al 6, lesión hipotalámica y del polígono de Willis, fistula de LCR, Existen trabajos17,26 sobre resección de creaneofaringiomas por vía transeptoesfenoidal; pero dada la anatomía y biología de estos tumores2,59 es preferible intentar primero una exéresis por vía alta ante la sospecha clínico-radiológica, porque resulta dificultosa la disección debido a las fuertes adherencias que posee y a la presencia de calcificaciones y la relación con vasos perforan-tes de la aCI y aComP50. La curación es mediante la exéresis total59.
La vía subfrontal está indicada en los tumores que comprometen la pared anteroinferior del TV y que no son accesibles a una vía transeptoesfenoidal porque el seno no está neumatizado o la silla turca es pequeña. La vía subfrontal requiere de una craneotomía frontal uni o bilateral, en este caso se liga el seno longitudinal superior y se secciona la hoz del cerebro en la base de la fosa anterior, La exposición se continúa con la reclinación del lóbulo frontal hasta visualizar los nervios olfatorio, óptico, quiasma y el complejo de la arteria comunicante anterior. Mediante una vía subfrontal se accede a un abordaje translámina terminalis, al espacio interóptico-quiasmático e interóptico-carotídeo principalmente.
Las vías de abordaje frontotemporal y subtemporal aportarán una visión anterolateral y lateral respectivamente sobre las regiones selar, supra selar y anteroinferior del TV. La de mayor uso en la actualidad es la frontotemporal, que se realiza mediante una craneotomía pterional56,58; pudiendo ampliarla a temporal para la vía de abordaje subtemporal utilizada por Symon y colaboradores50. La vía frontotemporal es muy versátil y permite el acceso al TV mediante los abordajes translámina terminalis, óptico-quiasmático o sub quiasmático, óptico-carotídeo, carótido-tentorial; y también al dorso selar, clivus y región prepeduncular58. También puede combinarse con las vías transcallosa, transfrontal y transeptoesfenoidal,
Luego de la craneotomía pterional se exponen los lóbulos frontal y temporal y se abre el valle silviano lo que permite una mayor reclinación de los mismos y aumenta la exposición, El centro de la vía de abordaje es el triángulo óptico-carotídeo, aunque también se podrán explorar los otros espacios paraquiasmáticos.
La vía subtemporal requiere una craneotomía pterional ampliada a temporal, luego se eleva la punta del lóbulo temporal exponiendo el borde libre del tentorio y así, se aborda el TV, región selar-supraselar y las caras anterior y lateral del mesencéfalo mediante una visión más lateral e inferior respecto de las otras vías. La entrada al TV puede hacerse a través del piso siempre que el mismo esté reducido a una membrana glial producto de la compresión crónica de un tumor que lo desplazó lateralmente.
Abordaje translámina terminalis (Fig. 7)
Está indicado en las lesiones que ocupan la porción anteroinferior de la luz del TV, especialmente aquellos de origen supraselar (craneofaringiomas) con un importante componente retroquiasmático preinfundibular; también en los casos de quiasma prefijado porque está limitado el acceso subquiasmático31,49.
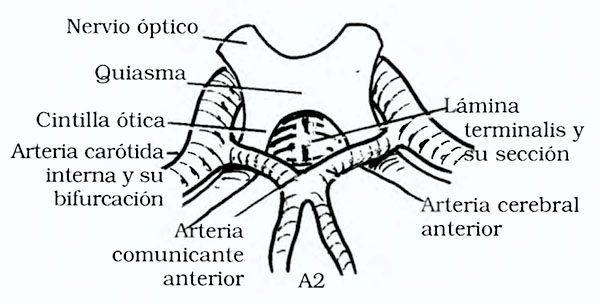
Fig 7. Abordaje translámina terminalis. Modificado de Rhoton y col.37.
Una vez en la región quiasmática se abre la aracnoides de la cisterna quiasmática y de la lámina terminalis; si la arteria comunicante anterior es larga y bloquea el acceso, se la puede seccionar49. A menudo el tumor protruye a través de la lámina terminalis, si el tumor es intraventricular la apertura de la misma lo expondrá38 en cambio, si el tumor es supraselar retroquiasmático y voluminoso la apertura de la lámina terminalis se acompañará de la apertura del piso del TV, es decir el hipotálamo, porque se encuentra distendido, elevado y aplicado contra la cara posterior de la lámina terminalis.
Shucart45 aconseja explorar siempre el área del receso infundibular, porque es el sitio más común en donde asientan los residuos tumorales (especialmente craneofaringiomas), punto de origen de las recidivas.
Las posibles complicaciones del abordaje translámina terminalis son: lesión de los pares 1 y 2, quiasma y tractos ópticos, hipotálamo, comisura anterior, fórnix, rostro y pico del cuerpo calloso, y complejo de la arteria comunicante anterior, aB y aCP.
Abordaje interóptico-quiasmático (Fig, 8)
Está indicado en los tumores de la región selarsupraselar que comprometen la pared anteroinferior del TV. Una vez en la región quiasmática se incide la aracnoides y se aborda el tumor entre los nervios ópticos y el quiasma, teniendo en cuenta que la movilización de los mismos debe ser mínima porque se incrementará el déficit visual.
El quiasma está normofijado en un 70% de los casos, retrofijado en un 15% y prefijado también en un 15%36. La presencia de un quiasma prefijado limita la exposición al espacio subquiasmático por lo que se puede considerar la vía de abordaje subfrontal-transesfenoidal31, que mediante la remoción del plano esfenoidal, tubérculo selar y la pared anterior de la silla turca aumentará el espacio subquiasmático a expensas del seno esfenoidal (Fig, 9). Finalizada la cirugía se debe sellar el mismo para prevenir la craneorrinorrea, Esta vía está indicada en los tumores selares-supraselares con o sin invasión al seno esfenoidal y quiasma prefijado.

Fig 8. Abordaje interóptico - quiasmático. Modificado de Rhoton y col.37

Fig. 9.Vía de abordaje subfrontal transes fenoidal. Modificado de Rhoton y col.37

Fig. 10. Abordaje interóptico carotídeo, Modificado de Rhoton y col.37
Abordaje óptico-carotídeo (Fig. 10)
Se realiza a través del triángulo óptico-carotídeo limitado por el nervio óptico por dentro, la aCI por fuera y la arteria cerebral anterior (Al) por arriba. Está indicado en los tumores selares-supraselares con proyección superolateral y que ensanchan el espacio óptico-carotídeo, Este abordaje se puede realizar mediante las vías de abordaje subfrontal, frontotemporal y subtemporal, y se puede combinar con los abordajes subquiasmático, translámina terminalis y carótido-tentorial. Muy delicadas deben ser las maniobras sobre el nervio óptico y la aCI, además de preservar las perforantes carotídeas al nervio óptico y al complejo infundíbulo-hipofisiario; como así también, las de la aComP que van al hipotálamo.

Fig. 11. Abordaje carótido-tentorial. Modificado de Rho-ton y col.37
Abordaje carótido-tentorial o retrocarotídeo (Fig. 11)
Está limitado por la aCI por dentro, el borde tentorial por fuera y el III par craneal por detrás. Está indicado en los tumores selares-supraselares con proyección posterolateral principalmente. Este abordaje necesita de las vías frontotemporal y/o subtemporal.
B) Abordajes a través del techo
Están indicados en las lesiones de la porción anterosuperior, con extensión a uno o ambos ventrículos laterales, tercio medio y posterior del TV excluyendo la patología de la región pineal. Las lesiones más frecuentes abordadas por el techo son el quiste coloideo, gliomas de tálamo y cisticercosis intraventricular en áreas endémicas. La hipertensión endocraneana por hidrocefalia obstructiva es el cuadro clínico más frecuente,
Controvertida ha sido la bibliografía en atribuir la responsabilidad de los trastornos de memoria e intelectuales a la sección del cuerpo calloso en las cirugías del TV. Si bien en la actualidad se atribuye que dichos déficit son causados por la sección uni o bilateral del fórnix, existen algunos indicios de trastornos en la información interhemisférica cuando se realizan callosotomías parciales54. Generalmente las alteraciones secundarias a una callosotomía parcial pasan desapercibidas para el propio paciente y solo son apreciadas en pruebas exploratorias específicas. Clásicamente se describen desórdenes en la transferencia visuoespacial, táctil y aprendizaje de tareas motoras bimanuales.
Apuzzo y colaboradores5 no han hallado en los postoperatorios de sus pacientes trastornos somatoestésicos o de información motora si se realiza una sección de hasta 2,5 cm en la porción anterior del cuerpo calloso.
Tradicionalmente se realizaba la sección uni o bilateral del fórnix con el objeto de ampliar el agujero de Monro; actualmente la mayoría de los autores coinciden en respetar la integridad del mismo, aunque hoy algunos recomiendan la fornicectomía en caso de necesidad siempre y cuando sea unilateral37. El papel del fórnix en el proceso de memoria está ampliamente aceptado; como así también, la participación de las estructuras que conecta es decir, el hipocampo y los cuerpos mamilares. Numerosos trabajos existen sobre la repercusión en la memoria luego de la sección del fórnix; básicamente con la movilización de ambos y la sección unilateral provocará amnesia para los hechos recientes generalmente transitoria, en cambio la sección bilateral la amnesia será definitivas.
Lavyne y Patterson25 aconsejan no realizar fornicectomía ni la aspiración del tubérculo anterior del tálamo (ambos son recursos para agrandar el agujero de Monto) propuesto por Ehni15 en los pacientes con déficit preoperatorio de la memoria porque al hacerlo se interrumpe el circuito de Papez: hipocampo-alveusfimbria-fórnix-tubérculos mamilares-haz mamilotalámico-núcleo anterior del tálamo- circunvolución del cuerpo calloso; y así, los trastornos mnésicos podrían agravarse.
Las vías de abordaje transcerebral-transventricular tienen indicaciones precisas; a pesar de ello, Yasargil y colaboradores59 prefieren no utilizarla por la posibilidad de desarrollar epilepsia y porencefalia postoperatoria; en cambio Rhoton y colaboradores37 la aconsejan cuando se plantea un abordaje subcoroideo, por tener una visión más lateral e inferior que la vía transcallosa.
Vía de abordaje transcallosa anterior
Indicada en los tumores ubicados en la posición anterosuperior del TV con proyección a uno o ambos ventrículos laterales, tercio medio y posterior. Tiene la ventaja de acceder a los ventrículos laterales y TV sin la necesidad de realizar corticotomías sin que exista hidrocefalia37.
La craneotomía generalmente trapezoidal con base en la línea media, está centrada en la sutura coronal (2/3 por delante y 1 /3 por detrás). Apuzzo y colaboradores5 en base a la disposición de las venas corticales que drenan al seno longitudinal superior observadas en angiografía o resonancia varían la localización de la craneotomía en sentido anteroposterior. Luego de abrir la duramadre se reclina el hemisferio cerebral (generalmente derecho) hasta exponer el cuerpo calloso. Se identifican las arterias pericallosas y se las diseca para movilizarlas, La sección del cuerpo calloso (medial o parasagital) no debe exceder los 2,5 a 3 cm de longitud comenzando desde la rodilla hacia atrás, tomando en cuenta que el agujero de Monro se encuentra aproximadamente en el trayecto de una línea imaginaria que se extiende desde la sutura coronal hasta el conducto auditivo externo.
Cuando la callosotomía es medial se entrará al cavum del septum pellucidum (se lo identifica fácilmente por carecer de LCR, plexo coroideo y venas subependimarias), avanzando en la disección por línea media se arribará al rafe interforniceal; en cambio, si se atraviesa la hoja del septum se entrará al ventrículo lateral. Una vez en el ventrículo lateral se identifica el plexo coroideo y se lo sigue hasta su extremo anterior donde confluye la vTE por fuera; este punto de convergencia coincide con el borde posterior del agujero de Monro. Siempre el plexo coroideo es medial y la vTE lateral; se debe tener presente esta relación para diferenciar si se entró al ventrículo lateral derecho o izquierdo. Si al finalizar la cirugía se cree que el TV no ha sido desbloqueado se puede realizar una amplia fenestración en el septum pelllucidum comunicando ambos ventrículos laterales, permitiendo si se quiere una sola derivación. Este procedimiento también es aplicable a la vía transcerebral-transventricular.
La vía transcallosa anterior permite realizar un abordaje interforniceal siguiendo estrictamente la línea media, ose podrá realizar un abordaje lateral al techo como el transforaminal o a la fisura coroidea.
Vía de abordaje transcallosa posterior
Prácticamente no se utiliza como abordaje al TV porque implicaría la sección de la comisura hipocámpica provocando amnesia definitiva.
Vías de abordaje transcerebral-transventricular
Pueden ser frontal, parietal y temporal. Esta última, o vía de Van Wagenen52 está destinada a las lesiones de la pared posterior. En general, las vías transventriculares se ven favorecidas ante la presencia de hidrocefalia.
La vía transventricular frontal está especialmente indicada en las lesiones que ocupan la porción anterosuperior y tercio medio del TV, y en particular a aquellas que se extienden a través del agujero de Monro al ventrículo lateral del lado en que la lesión es abordada. La craneotomía frontal está centrada en F2, se realiza una corticotomía de 4 cm en sentido anteroposterior y se profundiza la disección hasta penetrar el ventrículo lateral37. Una vez dentro, se reconocen las estructuras intraventriculares y se debe evitar la colocación de espátulas en la pared lateral frente al agujero de Monro, porque a este nivel se encuentra la rodilla de la cápsula interna en una situación subependimaria.
La vía transventricular parietal está indicada en las lesiones del TV con extensión al atrio ventricular y tálamo. La corticotomía se realiza en la circunvolución parietal superior evitando así, la lesión de la vía visual y el área del lenguaje. La entrada ventricular es a nivel del atrio y por esta vía se expone el tercio posterior del TV y su pared posterior.
Abordaje medial al techo o interforniceal (Fig. 12)
Actualizado y popularizado por Apuzzo quien lo utiliza para la totalidad de las lesiones del TV. La maniobra interforniceal fue originalmente descripta por Busch8 en 1944, y Baldwin7 en 1963 sugirió la vía completa transcallosa-interforniceal en laboratorio4.
La vía transcallosa anterior ofrece el mejor campo para el abordaje interforniceal, porque se continúa la disección por la línea media comenzada en el cuerpo calloso. Este abordaje elimina la necesidad de seccionar el fórnix, vTE o resecar el tubérculo anterior del tálamo para agrandar el agujero de Monro. El abordaje interforniceal puede realizarse fácilmente si luego de la callosotomía se entra al cavum del septum pelllucidum. Generalmente la presencia de un tumor con cierto volumen separa en alguna porción a los fórnices facilitando la entrada al rafe interforniceal. La apertura del rafe comienza detrás del agujero de Monro y no debe exceder los 20 mm por la posibilidad de lesión de la comisura hipocámpica.

Fig. 12. Abordaje medial al techo o interforniceal. A. Vista superior. B. Vista coronal. Moderado de Apuzzo3
Apuzzo y colaboradores5 concluyen que el abordaje interforniceal es una alternativa quirúrgica posible y asegura en el manejo de las lesiones tumorales y vasculares del TV, permitiendo una visualización de toda la cavidad ventricular y con mínimas consecuencias (generalmente trastornos transitorios en la memoria reciente).
Abordajes laterales al techo (Fig. 13)
El espacio comprendido entre el tálamo y el fórnix a nivel del cuerpo de los ventrículos laterales corresponde al borde lateral del techo del TV. El l/3 anterior de dicho espacio tiene una separación mayor y delimita el agujero de Monro, en cambio los 2/3 posteriores delimitan un espacio muy estrecho y corresponde a la porción corporal de la fisura coroidea donde se inserta el plexo coroideo. Así, los abordajes laterales al techo pueden ser: transforaminales si se realizan a través del agujero de Monro, supracoroideo y subcoroideo si se realizan a través de la fisura coroidea por arriba o por debajo del plexo coroideo respectivamente; por último, el abordaje transforniceal. Los abordajes laterales pueden ser realizados mediante las vías de abordaje transventricular frontal y transcallosa anterior. Esta cuenta con la ventaja de explorar a ambos lados por ser medial, en cambio pocas veces se podrá explorar completamente el espacio intertálamo-forniceal contralateral por vías de abordaje transventricular frontal y transcallosa anterior.

Fig. 13. Abordajes laterales al techo. Vista del ventrículo lateral derecho, (Modificado de Apuzzo4).
Abordaje transforaminal
Muy útil en los tumores del TV que atraviesan el agujero de Monro. Frecuentemente el agujero está agrandado por el tumor y/o hidrocefalia lo que facilita el abordaje. Cuando el agujero es pequeño existen tres opciones para agrandarlo y así aumentar la exposición al TC.
1° Fornicectomía: es la sección del pilar anterior del fórnix por delante del agujero de Monro y por debajo de la vena septal anterior. Si bien en la actualidad la mayoría de los autores la desaconsejan por los trastornos mnésicos; Rho-ton y colaboradores37 entre otros la recomiendan a condición de no realizarla en forma bilateral. Ehni15 concluye que la fornicectomía unilateral puede no tener trastornos evidenciables en muchas ocasiones, pero nunca se está seguro que el fórnix contralateral esté afectado por el tumor que se va a resecar.
2° Sección de la vTE: este procedimiento se describió como alternativa a la fornicectomía18. La sección se realiza a nivel del borde posterior del agujero de Monro y se complementa en caso de ser necesario con una apertura subcoroidea; de esta manera se eleva el plexo coroideo que arrastra a su vez al techo (fórnix más tela coroidea), aumentando aún más la exposición. Así, mediante esta maniobra, se desinserta el techo de la pared lateral comunicando el agujero de Monro con la fisura coroidea.
La sección de la vTE puede cursar en forma asintomática; aunque se ha descripto somnolencia, hemiplejia, mutismo por infarto hemorrágico de los ganglios basales18. Lavyne y Patterson25 aconsejan la sección de la vTE siempre y cuando exista en la angiografía preoperatoria una vena directa lateral importante que asegure el drenaje venoso de los ganglios basales.
3° Remoción del núcleo anterior del tálamo: el borde anteroinferior del agujero de Monro está ocupado por el tubérculo anterior del tálamo en cuyo interior están los núcleos anteriores. La remoción de ellos propuesto por Ehni15 representa otra alternativa a la fornicectomía en función de agrandar el agujero de Monro. Esta remoción es cuestionada por Lavyne y Patterson25, porque los núcleos anteriores forman parte del circuito de Papez y por tanto podrían agravarse los trastornos mnésicos preexistentes.
Abordaje a la fisura coroidea
1) Subcoroideo: descripto casi simultáneamente por Delandsheer y colaboradores13, y Sehrbundt Viale y colaboradores42 en 1978, quienes lo denominaron abordaje intertálamo-trigonal y subcoroideo respectivamente53. Resulta útil en las lesiones ubicadas detrás del agujero de Monro yen especial si están próximas al techo, ya que se obtiene una amplia exposición del tercio medio del TV.
El abordaje subcoroideo puede realizarse a partir de una vía de abordaje transcallosa anterior o transventricular frontal, aunque Rhoton y colaboradores37 aconseja la segunda porque al entrar más lateral e inferior mejora el ángulo de visión. Una vez en el ventrículo lateral se identifica el agujero de Monro, plexo coroideo y vTE. El área de trabajo está por detrás de la misma y debajo del plexo coroideo; este es el abordaje subcoroideo estricto descripto por Viale; en cambio Delandsheer13 y Hirsch18 por separado preconizan la sección de la vTE uniendo así el abordaje subcoroideo al transforaminal25. Luego de elevar el plexo coroideo (envuelto por la tela coroidea), se liberan las adherencias laxas entre la tela coroidea y el epéndimo que cubre al tálamo, pudiendo a veces encontrar alguna vena o arteriola que puede ser sacrificada sin problema11,53. Así se arriba a la luz del TV desplazando hacia arriba y adentro el plexo coroideo, fórnix y los elementos que transcurren por la tela coroidea (vCI y aCoPM). De esta manera el cirujano podrá trabajar a través de dos aberturas: una anterior, natural, que corresponde al agujero de Monro; y una posterior, artificial, que corresponde a la fisura coroidea abierta por debajo del plexo coroideo. A veces la vena directa lateral, que transcurre por detrás de la vTE y desemboca en la vCI, puede limitar la apertura subcoroidea. Es necesario recordar que la vena directa lateral no siempre es un vaso insignificante y a veces es más importante que la vTE, debiendo valorar correctamente me diante la angiografía preoperatoria y la visión quirúrgica a fin de elegir la vena a sacrificar para ganar espacio en caso de ser necesario.
2) Supracoroideo: indicado prácticamente en las lesiones vasculares cuyos vasos nutricios provienen de la tela coroidea. La disección comienza por arriba del plexo coroideo justo en el límite con el fórnix accediendo rápidamente a la tela coroidea (hoja superior), y a través de ésta a su contenido.
Abordaje transforniceal
Poco utilizado, expone el tercio posterior del techo a nivel de la anastomosis de ambas vCI. Luego de realizar una vía transventricular parietal se expone el atrio ventricular. Se identifica el plexo coroideo que está por dentro del tálamo y por debajo del cuerpo calloso, entre éste y el plexo coroideo se ubica el cuerpo y pilar posterior del fórnix. Se lo incide en dirección a sus fibras hasta llegar a la tela coroidea, sin comprometer la comisura hipocámpica ni el fórnix contralateral. Al entrar a la tela coroidea se desplaza hacia el lado opuesto las vCI, vGA y la aCoPM; exponiendo así, el tercio posterior y la pared posterior del TV.
C) Abordajes a través de la pared posterior
Las lesiones del tercio posterior y la pared posterior del TV se agrupan genéricamente en la patología de la región pineal. Los tumores pineales son por lejos la patología más frecuente de la región, el resto está repartido entre los tumores de tálamo, esplenio del cuerpo calloso, cerebelo, ten-torio que invaden secundariamente la región. Los tumores pineales comprenden del 0.4 al 1% de los tumores endocraneanos en series americanas y europeas, ascendiendo al 5% en el Japón, desconociéndose el motivo de ello44.
La región pineal tradicionalmente fue considerada dificultosa y peligrosa para abordar, debido a la distancia que la separa de la duramadre y la compleja red venosa que la rodea. El manejo de los tumores fue siempre controvertido y ha cambiado a lo largo del tiempo. En el pasado se indicaba la operación paliativa o derivación ventricular seguida de radioterapia, basado en la alta morbimortalidad operatoria de esa época sumado a que el 70% de los tumores son radiosensibles29. El esquema derivación más radioterapia aportó resultados satisfactorios con una tasa de mortalidad menor al 5% y una sobrevida a los 5 años del 60 al 75% (85% para los germinomas) versus una mortalidad operatoria del 30 al 70% y una morbilidad de más del 65% en las primeras décadas del siglo XX22.
A partir de la década del 70 Stein46 y Jamieson20 por separado comenzaron sus comunicaciones con resultados promisorios. En la actualidad con los avances anestésicos, diagnósticos y de técnica microquirúrgica se ha reducido la tasa de mortalidad operatoria a menos del 5%. La ventaja evidente de la cirugía es sobre el 30% de los tumores pineales que se caracterizan por ser benignos, encapsulados y radiorresistentes47.
Dada la diversidad de tumores y la baja morbimortalidad operatoria actual asociado a los daños de la radioterapia en niños, Edwards y colaboradores14 aconsejan conocer primero la histología del tumor en todos los casos antes de planificar el tratamiento definitivo.
Actualmente existen dos alternativas terapéuticas a la cirugía convencional. La primera basada en la radiosensibilidad de los germinomas (60% de los tumores pineales) aplica primero 2000 Rads sobre el tumor y si en la TAC de cerebro con contraste postradioterapia se reduce significativamente el volumen tumoral, se entiende que es un germinoma y se completa hasta los 5000 Rads. Esta alternativa es la llamada biopsia biológica positiva; en caso de ser negativa se indica de cirugía convencional. La segunda alternativa es realizar primero una biopsia estereotáxica y de acuerdo al tipo de tumor se elabora el plan terapéutico. Esta modalidad encuentra cierta resistencia en los neurocirujanos más agresivos debido a las posibles complicaciones de la biopsia: hemorragia, altamente peligrosa en esta región y la potencial aparición de implantes metastásicos a lo largo del trayecto de la aguja-tracker35.
Los tumores más frecuentes son el germinoma (60%), teratomas malignos (15%), tumores derivados de las células pineales (10-15%) y el resto está repartido entre gliomas de tálamo, teratomas benignos, meningiomas, etc. Los teratomas malignos y pineoblastomas deberían operarse lo antes posible porque la respuesta a la radioterapia es poco satisfactoria.
La mayoría de los pacientes con tumores pineales se presentan con hidrocefalia por obstrucción del acueducto, pero el hallazgo característico es el síndrome de Parinaud.
Luego de hacer el diagnóstico de tumor de la región pineal basado en la clínica, radiología, marcadores tumorales en sangre y LCR se planificará el abordaje. Las vías más utilizadas en la actualidad son la occipital transtentorial y la supracerebelosa infratentorial. La vía se elegirá de acuerdo a la localización y proyección tumoral, y además pesará sobre la elección el conocimiento y experiencia que el neurocirujano tenga sobre una u otra vía.

Fig. 14. Vía de abordaje suboccipital transtentoríal. Modificado de Rhoton y col.31
Vía de abordaje occipital transtentorial (Fig. 14)
La vía fue originalmente propuesta por Horrax19 y luego modificada por Poppen32 en 1966 y Jamieson20 en 1971, se la conoce por vía de Poppen. Está indicada en los tumores de la región pineal, especialmente en aquellos centrados o ubicados por arriba del borde tentorial con escasa extensión a la fosa posterior o al lado opuesto del abordaje. Una desventaja de esta vía es que la vGa y tributarias a menudo obstruyen el abordaje, además no provee adecuada visualización de la mitad contralateral del tálamo y la placa cuadrigeminal.
En la actualidad la vía occipital transtentorial se realiza de acuerdo a la descripción de Clark10. El paciente se coloca en posición de banco de plaza (derecha abajo) con un decúbito intermedio (entre lateral y ventral). Otra posición alternativa es sentado con la cabeza ligeramente inclinada a la derecha27.
Se aborda por craneotomía occipital "derecha" bien basal y medial hasta exponer el seno longitudinal superior, tórcula y seno lateral derecho; el lóbulo occipital derecho cae por gravedad al estar debajo de la hoz y se elimina la necesidad de usar espátula disminuyendo la posibilidad de daño a la corteza visual. El tentorio se divide por fuera y paralelo al seno recto hasta el borde libre, la vGa y tributarias aparecerán en el campo siempre por arriba de la región pineal. El esplenio estará por arriba y a veces elevado por el tumor; vermis superior, placa cuadrigeminal, IV par homolateral, aCeS y la vena cerebelosa precentral por debajo del tumor, la vbR ipsilateral, aCoPM, aCP y el tálamo estarán por fuera.
Vía de abordaje supracerebelosa infratentorial (Fig. 15)
Inicialmente utilizada por Horsley en 1910, descripta por Krause24 en 1926, modificada y popularizada por Stein46,48 en 1971. Está indicada en los tumores de región pineal, especialmente aquéllos que crecen hacia el TV y la fosa posterior. La exposición está limitada por arriba del tentorio y en especial a nivel paramediano en la región posterior del TV48.
Reid y Clark33 comparan esta vía con la occipital transtentorial afirmando que la lesión está alojada profundamente y la red venosa aparece al final de la cirugía, por ello la ventaja es la vía supracerebelosa. Una desventaja es la posibilidad de embolia gaseosa; además, es poco confortable para el cirujano y ayudante6.
El paciente se coloca "sentado" y se realiza una craniectomía suboccipital medial alta que exponga la tórcula y ambos senos laterales, el acceso a la región pineal es entre la superficie superior del cerebelo y la inferior del tentorio. La vGa y ambas vCl están por arriba, la vena cerebelosa precentral está por detrás y en la línea media; tálamo, aCoPM, aCP y vbR por fuera; por último, la placa cuadrigeminal, nervio troclear, aCeS y el vermis superior por abajo.
Sekhar y Goel43 recientemente describieron un abordaje que combina la vía occipital transtentorial y la supracerebelosa infratentorial con sección del seno lateral y posterior anastomosis al finalizar la cirugía. Estos autores la sugieren para grandes tumores y malformaciones vasculares que se extienden por arriba y debajo del hiato tentorial.

Fig. 15.Vía de abordaje supracerebeloso infratenlorial. Modificado de Rhoton y col.31
Vía de abordaje transcallosa posterior
Actualmente en desuso para las lesiones de la región pineal sólo está indicada cuando el tumor compromete además el esplenio del cuerpo calloso. Esta antigua vía de abordaje o vía de Dandy secciona el esplenio del cuerpo calloso para luego observar a ambos fórnices (pilares posteriores y comisura hipocámpica) y la vGa que se interponen con la glándula pineal.
En caso de lesiones pequeñas Yasargil y colaboradores57 recomiendan la sección transversal del esplenio siguiendo la dirección de sus fibras, lo cual evita la lesión de fibras comisurales que conectan las áreas primarias y secundarias visuales.
Las vías transventricular temporal de Van Wagenen52 descripta en 1931 y la subtemporal posterior no tienen indicación en la actualidad.
CIRUGÍA MÍNIMAMENTE INVASIVA DEL TERCER VENTRÍCULO
La ventriculoscopia simple, utilizada por Dandy en 1922 y en nuestro país por Orlando41 en 1931, permitió el desarrollo de técnicas altamente sofisticadas y utilizadas en la actualidad para la exploración del TV y ventrículos laterales fundamentalmente. Entre estas técnicas se encuentra el desarrollo de los equipos endoscópicos de diámetro reducido pudiendo realizar biopsias, aspiración de quistes, hemostasia con pinzas de coagulación o láser e implantación de material radioactivo. También la estereotaxia guiada por TAC, IRM y angiografía digital permite la aproximación a la lesión en forma precisa y segura. En la actualidad la cirugía mínimamente invasiva combina los principios de la estereotaxia, neuroimágenes, computación, técnicas microquirúrgicas, óptica, creando una nueva dimensión en el manejo de los procesos endocraneanos.
Apuzzo3 con amplia experiencia en la cirugía convencional del TV enfatiza las ventajas del abordaje estereotáctico. Utilizó en más de 750 procedimientos el sistema de Brown-RobertsWells, correspondiendo 150 lesiones del TV. Remarca que el acceso es rápido (60 minutos) y seguro. Mediante esta modalidad realizó determinaciones histológicas y microbiológicas, aspiración de quistes y abscesos, instalación de sistemas de drenaje, colocación de fuentes radioactivas, cerebroscopia y ventriculoscopia con biopsia, aspiración y escisión. Los objetivos se cumplieron en un 97%, con biopsias positivas en un 95%; la morbilidad fue menor al l%, al igual que la mortalidad, La craneotomía posterior fue indicada o requerida en menos del 20%.
Apuzzo finalmente concluye que este método es uno más en el manejo de las lesiones del TV. Conocer la histología en las lesiones intraaxiales pueden ser drenadas bajo control preciso y dejar sistemas de drenaje o fuentes radioactivas. Los quistes intraventriculares pueden ser aspirados bajo visualización endoscópica y resecados totalmente.
Recientemente Morita y Kelly30 publicaron su trabajo acerca de la técnica estereotáxica volumétrica asistida por computadora, su experiencia asciende a 60 procedimientos en 58 pacientes. La patología fue muy variada, y accedieron completamente a los ventrículos laterales y tercio anterior del TC. La técnica consiste en abordar el ventrículo lateral mediante una corticotomía utilizando un espéculo cilíndrico de 2 a 3 cm de diámetro fijado a un marco y guiado por computación, combinando técnicas estereotácticas y microquirúrgicas. El tamaño de la craneotomía no supera los 4 o 5 cm y el de la corticotomía los 2 o 3 cm, a través del espéculo pasa el instrumental, cánulas de aspiración y el sistema láser con CO2.
La mortalidad quirúrgica fue de 3,4% y las complicaciones postoperatorias en los tumores del TV fueron: trastornos mnésicos definitivos (2 casos), transitorios (2 casos), trastornos de la conciencia (2 casos), hidrocefalia aguda (2 casos), secreción inadecuada de ADH (1 caso), higroma subdural (l caso) y convulsiones (2 casos).
Los autores concluyen que esta técnica utiliza un trayecto seguro y evita el daño de corteza y vías subcorticales elocuentes. Puede realizarse con ventrículos pequeños y resecar tumores con un diámetro mayor al espéculo a través de movimientos coordinados del mismo; cabe destacar que el diámetro del espéculo provee adecuado espacio de trabajo con mínima compresión cerebral. Una desventaja significativa es que no puede utilizarse en las grandes fisuras; por ejemplo, la interhemisférica para la vía transcallosa, o la vía subfrontal en el abordaje translámina terminalis.
CONCLUSIÓN
Las lesiones ubicadas en la región del TC son las más dificultosas de exponer y resecar, y el abordaje a la cavidad o alguna de sus paredes implica la sección de estructuras nerviosas y vasculares. Esta lesión neurovascular producto del abordaje junto al daño local secundario a la exéresis de la lesión ha marcado la evolutividad de la cirugía del TV durante este siglo. Los malos resultados en los primeros abordajes determinó por un lado conductas conservadoras o menos agresivas; otros en cambio, perfeccionaron el manejo de estas lesiones ampliando sus conocimientos en anatomía, fisiología, clínica neurológica y neuroquirúrgica, radiología y microtécnicas quirúrgicas permitiendo en la actualidad cirugías regladas con baja morbimortalidad operatoria.
En la presente revisión se propone una clasificación de abordajes ya conocidos al TV basada en la localización de la lesión y en la pared ventricular implicada en el mismo. Así, los abordajes al TV pueden ser a la pared anteroinferior, pared superior o techo y a la pared superior.
A) Los abordajes a la pared anteroinferior se los divide en translámina terminalis, al espacio subquiasmático, al espacio óptico-carotídeo y al espacio carótido-tentorial. El abordaje translámina terminalis está indicado en las lesiones supraselares con crecimiento anterior y superior, y que la pared inferior se aplique detrás de la pared anterior del TV; el ejemplo típico es el craneofaringioma.
El abordaje al espacio subquiasmático es preferible hacerlo desde una vista anterior mediante una vía subfrontal. Si el quiasma está normo o retrofijado el espacio será suficiente para explorarlo, en cambio si está prefijado se utiliza la vía subfrontal transesfenoidal que reseca el tubérculo selar, plano esfenoidal y pared anterior de la silla turca aumentando el espacio interópticoquiasmático o subquiasmático a expensas del seno esfenoidal.
Los abordajes óptico-carotideo y carótido-tentorial se realizan mejor desde una vista anterolateral y lateral mediante una vía frontotemporal y subtemporal respectivamente, estos abordajes se indican cuando el tumor tiene proyección hacia la región paraselar y fosa media generalmente,
Cuando la lesión es intraselar y comprime secundariamente la pared anteroinferior del TV puede ser abordado mediante una vía transeptoesfenoidal. Para efectuarla es necesario que, el eje mayor del tumor coincida con el eje de al vía, exista una silla turca agrandada y un seno esfenoidal neumatizado.
B) Los abordajes al techo están indicados cuando las lesiones ocupan la porción superior del TV. El abordaje interforniceal requiere una vía transcallosa anterior pudiendo explorar la totalidad de la cámara tercerventricular.
Los abordajes entre el tálamo y el fórnix pueden efectivizarse mediante las vías transcallosa y transcerebral transventricular. La entrada al TV es a través del agujero de Monro o la fisura coroidea (supra y subcoroideo). Las lesiones del tercio anterior con extensión al ventrículo lateral que agrandan el agujero de Monro pueden abordarse en forma transforaminal; si el agujero es normal puede agrandarse mediante la sección del pilar anterior del fórnix, ligadura y sección de la vTE o la aspiración del tubérculo anterior del tálamo.
El abordaje subcoroideo permite explorar el tercio medio y gran parte del posterior abriendo la brecha entre el plexo coroideo y el tálamo. Las lesiones vasculares del techo se acceden mejor desde un abordaje supracoroideo (entre el plexo coroideo y el fórnix).
C) Los abordajes a la pared posterior están generalmente indicados a la patología de la región pineal. La vía transcallosa posterior se utiliza cuando el tumor crece hacia el esplenio o viceversa. La vía transventricular posterior cuando el tumor crece hacia el pulvinar y el atrio ventricular.
La vía suboccipital transtentorial es para los tumores pineales con un mayor componente hacia el pulvinar o por arriba del tentorio, en cambio la vía supracerebelosa infratentorial cuando el mayor componente está por debajo del tentorio o compromete el vermis.
La cirugía mínimamente invasiva reduce las exposiciones, el daño neurovascular es mínimo con abordajes precisos y seguros basado en técnicas microquirúrgicas y estereotácticas, óptica y computación.
Todos los abordajes son posibles y seguros. Es necesario y fundamental conocer la anatomía microquirúrgica del TV y de las regiones por donde transcurre el abordaje. Los estudios neurorradiológicos actuales brindan información acerca de la localización, proyección y tipo de lesión; como así también, el estado de las estructuras neurovasculares regionales (compresión, desplazamiento e infiltración).
De los conocimientos anatómicos, fisiológicos, clínico y radiológico el neurocirujano deberá elaborar la estrategia quirúrgica que más favorezca al paciente, conociendo los riesgos que implican cada uno de los abordajes al TV.
Bibliografía
1. Abe T, Sugishita M, Yatsuzuka S et al: Transcallosal interforniceal approach for a posteriorly projecting high basilar bifurcation aneurysm. J Neurosurg 78: 970-973, 1993.
2. Adamson TE, Wiestler OD, Kleihues P et al: Correlation of clinical and pathological features in surgically treated craniopharyngiomas. J Neurosurg 73: 12-17, 1990.
3. Apuzzo MLJ: Surgery of masses affecting the third ventricular chamber: techniques and strategies. Clin Neurosurg: 449-522, 1986.
4. Apuzzo MLJ: Transcallosal interforniceal exposure of lesion of the third ventricle. En: Operative neurosurgical techniques. Schmidek HH y Sweet WH. (ed). Grune & Stratton, Inc. 1988, pp 389-396.
5. Apuzzo MLJ, Chikovani OK, Gott PSet al: Transcallosal, interforniceal approaches for lesions affecting the third ventricle: surgical considerations and consequences. Neurosurgery 10: 547-554, 1982,
6. Ausman JI, Malik GM, Dujovny M et al: Threequarter prone approach to the pineal tentorial region. Surg Neurol 29: 298-306, 1988.
7. Baldwin M, Ommaya AK, Farrier R et al: Mesial cerebral incision. J Neurosurg 20: 679-686, 1963. Referido en Apuzzo (4).
8. Busch E: A new approach for the removal of tumors of the third ventricle. Acta Psychiatr Scand 19: 57-
60, 1944. Referido en Apuzzo (4).
9. Cambolat A, Onal C and Kris T: A hig-position basilar top aneurysm approached via third ventricle: Case report. Surg Neurol 39: 196-199, 1993.
10. Clark K: The occipital transtentorial approach to the pineal region. En: Operative neurosurgical techniques. Schmidek HH and Sweet WH. (ed). Grune & Stratton, Inc. 1988, pp 411-418.
11. Cossu M, Lubinu F, Orunesu G et al: Subchoroidal approach to the third ventricle. Surg Neurol 21: 325-331, 1984.
12. De los Reyes RA, Kantrowitz AB, Boehm FH et al: Transcallosal, transventricular approach to a basilar apex aneurysm.
Neurosurgery 31: 597-602, 1992,
13. Delandsheer JM, Guyot JF, Jomin M et al: Acces au troisieme ventricule par voie interthalamo-trigonale. Neurochirurgie 24: 419-422, 1978. Referido en Viale y Turtas (53).
14. Edwards MSB, Hudgins RJ, Wilson CB et al: Pineal region tumors in children. J Neurosurg 68: 989997, 1988.
15. Ehni G: Interhemispheric and percallosal (transcallosal) approach to the cingulate gyri, intraventricular shunt tubes, and certain deeply placed brain lesions. Neurosurgery 14: 99-110, 1984.
16. Geffen G, Walsh A, Simpson O et al: Comparison of the effects of transcortical and transcallosal removal of intraventricular tumours. Brain 103: 773788, 1980.
17. Hardy J: Transsphenoidal hypophisectomy. J Neurosurg 34: 582-594, 1971.
18. Hirsch JF, Zovaou A, Tlenier D et al: A new surgical approach to the ventricle with interruption of the striothalamic vein. Acta Neurochir (Wien) 47: 135147, 1979. Referido en Lavyne y Patterson (25).
19. Horrax G: Extirpation of a huge pinealoma from a patient with pubertas praecox: A new operative approach. Arch Neurol Psychiatry 37: 385-397, 1937. Referido en Jamieson (20).
20. Jamieson KG: Excision of pineal tumors. J Neurosurg 35: 550-553, 1971.
21. Jeeves MA, Simpson DA, Geffen G: Functional consequences of the transcallosal removal of intraventricular tumours. J Neurol Neurosurgery Psychiatry 42: 134-142, 1979.
22. Jooma R, Kendall B: Diagnosis and management of pineal tumors. J Neurosurg 58: 654-665, 1983.
23. Katayama Y, Tsubokawa T, Saijo M et al: Surgical management of cavernous malformations to the third ventricle. J Neurosurg 80: 64-72, 1994.
24. Krause F: Operative Freilegung der Vierhügel, nebst Beobachtungen über Himdruck und Dekompression. Zentralbl Chir 53: 2812-2819, 1926. Referido en Stein (48).
25. Lavyne MH, Patterson RH: Subchoroidal transvelum interpositum approach to mid-third ventricular tumors. Neurosurgery 12: 64-
72, 1983.
26. Laws ER Jr: Transsphenoidal microsurgery in the management of craniopharyngioma. J Neurosurg 52: 661-666, 1980.
27. Lazar ML, Clark WK: Direct surgical management of masses in the region of the vein of Galen. Surg Neurol 2: 17-21, 1974.
28. Long DM, Chou SN: Transcallosal removal of craniopharyngiomas within the third ventricle. J Neurosurg 39: 563-567, 1973.
29. Marsh WR, Laws ER Jr: Shunting and irradiation of pineal tumors. Clin Neurosurg 32: 384-396, 1985.
30. Morita A, Kekky PJ: Resection of intraventricular tumors via a computer-assisted volumetric stereotactic approach. Neurosurgery 32: 920-027, 1993.
31. Patterson RH, Danylevich A: Surgical removal of cranipharyngiomas by a transcranial approach through the lamina terminalis and sphenoid sinus. Neurosurgery 7: 11-117, 1980.
32. Poppen JL: The right occipital approach to a pinealoma. J Neurosurg 25: 706-710, 1966. Referido en Clark (10).
33. Reid WS, Clark WK: Comparison of the infratentorial and transtentorial approaches to the pineal region. Neurosurgery 3: 1-8, 1978.
34. Renfro M, Delashaw JB, Peters K et al: Anterior third ventricle meningioma in an adolescent: a case report. Neurosurgery 31: 746-750, 1992.
35. Rosenfeld JV, Murphy MA, Chow CW: Implanta tion metastasis of pineoblastoma after stereotactic biopsy. J Neurosurgery 73: 287-290, 1990.
36. Rhoton AL, Hardy DG, Chambers SM: Microsurgical anatomy and dissection of the sphenoid bone, cavernous sinus and sellar region. Surg Neurol 12: 63-104, 1979.
37. Rhoton AL, Yamamoto I, Peace DA: Microsurgery of the third ventricle: Part 2, Operative approaches. Neurosurgery 8: 357-373,
1981.
38. Schijman E: Abordaje trans-lámina terminalis. Correlación anátomo-quirúrgica. Comunicación personal. Hospital de Niños
"Ricardo Gutiérrez".
39. Schijman E, Monges J, Raimondi AJ et al: Choroid plexus papillomas of the III ventricle in childhood. Their diagnosis and surgical management. Child's Nerv Syst 6: 331-334, 1990.
40. Schijman E: Letter to the editor. Child's Brain 11: 349-352, 1984.
41. Schijman E: Vías de abordaje quirúrgico a las lesiones del tercer ventriculo. Tesis de doctorado Facultad de Medicina. UBA 1987.
42. Sehrbundt Viale E, Pau A: Approccio chirurgico al terzo ventricolo per via subcoroidea. S Sassaresi 56: 397, 1978. Referido en Viale y Turtas (53).
43. Sekhar LN, Goel A: Combined supratentorial and infratentorial approach to large pineal-region meningioma. Surg Neurol 37: 197-201, 1992.
44. Shi-qui L, Deze L, Mozhi Z et al: Occipital transtentonal approach for removal of pineal region tumors: report fo 64 consecutives cases. Surg Neurol 32: 36-39, 1989.
45. Shucart W: Removal of tumors in the third ventricle. En: Neurosurgical procedures: personal approaches to classic operations. Wilson CB. (ed). Williams & Wilkins, Baltimore 1992, pp-52-62.
46. Stein BM: The infratentorial supracerebellar approach to pineal lesions. J Neurosurg 35: 197-202, 1971.
47. Stein BM: Surgical treatment of pineal tumors. Clin Neurosurg 26: 490-510, 1979.
48. Stein BM: Transcallosal approach to tumors of the third ventricle. En Operative Neurosurgical Techniques. Schmidek HH and Sweet WH. (ed). Grune Stratton, Inc 1988, pp 381-386.
49. Suzuki J, Katakura R, Mori T: Interhemispheric approach through the lamina terminalis to tumors of the anterior part of the third ventricle. Surg Neurol 22: 157-163, 1984.
50. Symon L, Sprich W: Radical excision of craniopharyngioma. Results in 20 patients. J Neurosurg 62: 174-181, 1985.
51. Tindall GT, Collins WF, Krichner JA: Unilateral septal technique for transsphenoidal microsurgical approach to the sella turcica. Technical note. J Neurosurg 49: 138-142, 1978.
52. Van Wagenen WP: A surgical approach for the remo-val of certain pineal tumors. Surg Gynecol Obstet 53: 216-220, 1931. Referido en Rhoton y col (37).
53. Viale GL, Turtas S: The subchoroidal approach to the third ventricle, Surg Neurol 14: 71-76, 1980.
54. Winston KR, Cavazzuti V, Antunes T: Absence of neurological and behavioral abnormalities after anterior transcallosal operation for third ventricular lesions. Neurosurgery 4: 386-393, 1979.
55. Yamamoto Y, Rhoton AL Jr, Peace DA: Microsurgery of the Third Ventricle: Part 1, Microsurgical anatomy. Neurosurgery 8: 334-356, 1981.
56. Yasagil MG, Antic J, Laciga R et al: Microsurgical pterional approach to aneurysm of the basilar
bifurcation. Surg Neurol 6: 83-91, 1976,
57. Yasargil MG, Jain KK, Antic J et al: Arteriovenous malformations of the esplenium of the corpus callo-sum: microsurgical treatment. Surg Neurol 5: 5-14, 1976.
58. Yasargil MG: Operative approach, En: Microneurosurgery. Yasargil MG. (ed) Georg Thieme Verlag. Stuttgart 1987. Vol 1, pp 215-233.
59. Yasargil MG, Curcic M, Kis M et al: Total removal of craniopharyngioma. J Neurosurg 73:3-11, 1990.
Actualización
Abordajes Quirúrgicos al Tercer Ventrículo
Segunda parte: Vías de abordaje
R. Mormandi
Instituto de Neurocirugía y Neurología "Prof. Dr. Enrique Pardal" Sanatorio Mitre, Buenos Aires
Correspondencia: Terrada 2785 (1417) Buenos Aires
RESUMEN
La entrada a la cavidad del tercer ventrículo implica la sección de elementos nerviosos y / o vasculares cuya ubicación, relaciones anatómicas y función se deben conocer a la hora de decidir la vía de abordaje con el fin de adecuar y optimizar la táctica quirúrgica que posibilite reducir los riesgos inherentes de la vía elegida.
En el presente trabajo se revisa y actualiza la bilbiografia existente sobre los abordajes quirúrgicos al tercer ventrículo. Se presenta una nueva clasificación sobre abordajes y vías de abordaje al tercer ventrículo basado en la localización de la lesión y a la pared del tercer ventrículo implicada en el abordaje. Así, los mismos pueden ser a través de la pared anteroinferior, techo y pared posterior.
Palabras clave: abordaje microquirúrgico, microneurocirugía, tercer ventrículo
ABSTRACT
The access to the third ventricular chamber implies the section of vascular and neural structures, whose location, anatomic relations and functions should be known at the time of choosing the apropiate operative route in order to adecuate the surgical tactic that allows to reduce the inherent rísks of the chosen approach.
The bibliography about surgical approaches of the third ventricle is reviewed and updated. A new clasification about approaches and operative routes to the third ventricle, based on the location of the lesion and the wall of the third ventricle implied in the approach, is introduced. They may be done out through the anteroinferior wall, the roof and the posterior wall.
Key words: microneurosurgery, microsurgical approach, third ventricle.
INTRODUCCIÓN
El abordaje al TV implica algún tipo de daño a la corteza cerebral, cuerpo calloso o pared ventricular, el riesgo de lesión de estructuras vasculares puede conducir a secuelas neurológicas transitorias o definitivas con una implicancia médicosocial importante.
La manipulación de las paredes ventriculares pueden causar disfunción hipotalámica provocando alteraciones en la regulación térmica, nivel de conciencia, respiración, manejo hidroelectrolítico, regulación hormonal y memoria, entre otros, Los trastornos visuales pueden deberse a lesiones sobre la vía óptica (nervio óptico, quiasma, cintilla., cuerpo geniculado, corteza cerebral o tercio posterior del cuerpo calloso). Los movimientos extraoculares se alteran con las lesiones en la pared posterior del TV. Las lesiones forniceales (bilaterales generalmente) se traducirán en trastornos de la memoria reciente. Las callosotomías conducirán a trastornos de la transferencia interhemisférica de información provocando un síndrome de desconexión. caracterizado por trastornos intelectuales (apatía, hipoquinesia, hipomnesia de tipo reciente); motores (apraxia ideomotriz); sensitivos (estereoagnosia) y sensoriales (agnosia visual16,21. El manejo de la corteza cerebral mediante incisión o retracción puede provocar contusiones, atrofia, infarto, porencefalia, traduciéndose en hemiparesia, convulsiones, trastornos de la conciencia, mutismo y defectos visuales.
De las lesiones arteriales, las que implican el sector anterior del polígono de Willis provocarán trastornos de memoria y personalidad; en cambio las que impliquen el sector posterior provocarán trastornos del nivel de conciencia y de los movimientos extraoculares. Las lesiones venosas dan déficit inconstantes pero no por ello dejan de ser importantes; la ligadura de la vGa es incompatible con la vida, generalmente. Esa inconstancia se debe probablemente a la diferente anatomía venosa de los pacientes, sistemas colaterales de drenaje y cantidad de anastomosis. La oclusión de la vCi o vTE puede cursar en forma asintomática o provocar somnolencia, hemiplejia o mutismo por infarto de los ganglios de la base.
La patología del TV es la que presenta mayor dificultad de exposición y exéresis quirúrgica. Apuzzo3 valiéndose de la tomografía computada, resonancia nuclear magnética y a veces de la angiografía cerebral clasifica a los procesos patológicos del TV en:
- Extraaxial intraventricular: de histología benigna con algunas áreas de adherencias a la pared ventricular. Son ejemplos el quiste coloideo, cisticercosis.
- Intraaxial con componente ventricular: son los tumores o malformaciones de las paredes con expresión hacia la luz ventricular. Por ejemplo: glioma, de tálamo.
- Basal: son los tumores de base de cráneo, selares-supraselares con expansión rostral hacia el TV. Si hay disrupción del piso será intra y extraventricular El ejemplo típico es el craneofaringioma.
Esta clasificación topográfica es importante para el diseño de la vía de abordaje, aunque no solo la topografía debe pesar sobre la elección de la misma sino además el tipo de lesión, presencia de hidrocefalia y cuadro clínico y neurológico.
Una amplia variedad de lesiones se originan en o secundariamente aparecen en el TV. Genéricamente se los divide en: tumorales: gliomas, germinomas, metástasis, craneofaringiomas, adenomas hipofisiarios, papiloma y carcinoma de plexo coroideo, meningiomas, tumores de la región pineal; vasculares: aneurismas, malformaciones arteriovenosas. cavernomas; infecciosas: abscesos, tuberculomas. cisticercosis y misceláneas: quiste coloideo, dermoideos, epidermoideos, ependimarios, aracnoideos, sarcoidosis. Los ependimomas originados del manto ependimario, los subependimomas y astrocitomas del tejido glial subyacente son tumores relativamente frecuentes y su evolución dependerá del grado de malignidad y localización.
Los craneofaringiomas son tumores de la región supraselar con invasión secundaria al TV. Los craneofaringiomas intraventriculares puros se originan probablemente de restos celulares de la eminencia media2.
Los adenomas hipofisiarios son tumores que en su crecimiento rostral comprometen la pared anteroinferior del TV.
Los meningiomas derivados de células aracnoidales, se desarrollan a partir de la tela coroidea. Son más frecuentes a nivel del atrio ventricular que en el TV, y en general los intraventriculares son más frecuentes en niños que en adultos34.
Los papilomas de los plexos coroideos se originan principalmente en el TV y se caracterizan por la hidrocefalia que producen. Esta puede ser obstructiva (por bloqueo del agujero de Monro) y/
o comunicante (por hipersecreción de LCR o hiperproteinorraquia)39,40.
Los tumores de la región pineal son generalmente malignos y están asociados a hidrocefalia por bloqueo del acueducto de Silvio.
La patología vascular no es tan frecuente aunque no deja de ser interesante. Recientemente se han publicado casos de aneurismas del tope de la aB con impronta o penetración en el piso del TV que se operaron por vía transcallosa o transventricular pasando por el TV1,9,12. Los cavernomas y malformaciones arteriovenosas puros del TV son poco frecuentes23.
La neurocisticercosis se caracteriza por quistes intracerebrales o intraventriculares que pueden migrar y crecer adheridos en alguna pared ventricular.
Los abscesos piógenos se desarrollan en general en el tálamo.
El quiste coloideo representa el clásico tumor benigno de la región y se origina de restos celulares de la parafisis, glándula rudimentaria que involuciona en el cuarto mes de vida fetal. Se localiza generalmente adherido a la tela coroidea del techo por detrás del agujero de Monro, contiene un material mucinoso con células epiteliales descamadas, eritrocitos, leucocitos y pigmento colesterínico. Debido a su localización y efectos mecánicos secundarios (pueden obstruir intermitentemente el agujero de Monro) representa una verdadera amenaza para la vida, por lo que siempre tienen indicación quirúrgica.
Los quistes ependimarios y aracnoideos contienen LCR y se diferencian por su localización; los primeros son intraventriculares y recubiertos por ependimocitos; en cambio, los segundos se originan en el velum interpositum y están cubiertos por aracnoides.
La hidrocefalia es una complicación que puede existir tanto en el pre como en el postoperatorio. La misma se debe al bloqueo del acueducto de Silvio o de los agujeros de Monro.
ABORDAJES Y VÍAS DE ABORDAJE AL TERCER VENTRÍCULO
Existen numerosos abordajes al interior o alguna de las paredes del TV. Es necesario aclarar ciertos aspectos en la terminología. La ruta o vía de abordaje comprende a todos los pasos y maniobras necesarias para llegar a una región determinada. Por ejemplo la vía de abordaje subfrontal. En cambio el abordaje específico implica los pasos y maniobras necesarias dentro de una región determinada. Por ejemplo el abordaje subquiasmático. Resumiendo, para llegar al espacio subquiasmático es necesario utilizar una vía de abordaje subfrontal y luego un abordaje subquiasmático.
En la Tabla 1 se describe la clasificación propuesta de abordajes al TV. Nótese que la celda correspondiente de los abordajes a través de la pared posterior está ausente, debido a que los mismos están dirigidos prácticamente a la región pineal por lo que solamente cambian las vías de abordaje. Completa esta clasificación un esquema sobre la indicación de los abordajes de acuerdo a las posibles localizaciones de los tumores en una vista sagital del TV (Fig. 5).

Fig. 5. Indicación de los abordajes de acuerdo a las posibles localizaciones de las lesiones en una vista sagital del TV.
Tabla 1. Clasificación de abordajes al tercer ventrículo

La elección del abordaje y vía de abordaje dependerá del cuadro clínico y neurológico, localización de la lesión tomando en cuenta su origen y proyección a estructuras vecinas, adherencias o puntos de contacto en alguna pared, presencia de hidrocefalia uni o biventricular y tipo de lesión; en caso de malformaciones vasculares es preferible abordarlas desde el pedículo nutricio; quizás existan más elementos que inclinen la balanza hacia alguna vía en especial, pero es aveces la experiencia del cirujano y la familiaridad con un a determinada vía de abordaje lo que hace tener más peso en la elección "acertadamente o no".
Frecuentemente se emplean dos o tres abordajes específicos por la misma vía de abordaje; por ejemplo, los abordajes subquiasmático, interóptico-carotídeo y carótido-tentorial a través de una vía de abordaje frontotemporal. Menos frecuente en su utilización es el abordaje combinado donde se emplean dos o más vías de abordaje mediante dos craneotomías generalmente simultáneas. Por ejemplo, con el abordaje transcalloso transforaminal las porciones de tumor debajo de la lámina terminalis y quiasma pueden ser no visibles; y al combinar esta vía de abordaje con una frontotemporal las porciones ocultas o ciegas dejarían de serlo. Los craneofaringiomas intra y extraventriculares son el ejemplo típico y más frecuente de cirugías con abordajes combinados, modalidad aconsejada por Yasargil y colaboradores59.
Existen una serie de maniobras básicas en neurocirugía que bien vale la pena recordar37:
• La retracción cerebral debe ser mínima. Debe tenerse en cuenta cuando alguna de las paredes de la vía elegida está fija: piso de la fosa anterior, media, posterior y la hoz del cerebro. Así, las craneotomías deben ser basales en las vías subfrontal, frontotemporal y subtemporal; o llegar al borde y exponer los senos venosos en las vías interhemisféricas, occipital transtentorial y supracerebeloso infratentorial.
• La incisión sobre tejido nervioso debe ser mínima. Son ejemplos la corteza cerebral, cuerpo calloso, etc.
• La ligadura de arterias y venas debe ser mínima. Numerosos elementos vasculares se observan en las diferentes vías desde la duramadre hasta el TV, por lo que el cirujano debe reconocerlos y seccionar lo mínimo posible.
• Vaciamiento intracapsular versus resección en bloque. En los tumores profundos se debe hacer primero un vaciamiento y luego la exéresis de la cápsula. El espacio se gana con el vaciamiento y no con la retracción innecesaria de tejido cerebral.
• La circulación de LCR debe estar asegurada. La hidrocefalia es una complicación que puede aparecer, incluso, en el postoperatorio. Aveces, es suficiente una apertura en la pared anterior, piso o posterior del TV de acuerdo a la cirugía; otras veces se puede reasegurar la tercerventriculostomía interna con un tubo de Silastic al espacio subaracnoideo regional o cisterna magna creando una derivación de Torkildsen modificada, o bien se puede dejar una ventriculostomía externa transitoria.
A) Abordajes a través de la pared anteroinferior
Son utilizados en las lesiones de la región selar, supraselar, paraquiasmática y que comprometen secundariamente al TV. Las lesiones más frecuentes son los tumores hipofisarios en los adultos y los craneofaringiomas en los niños. Clínicamente se presentan con déficit visual, disfunción hipotálamo-hipofisiaria y disturbios mentales.
Las diferentes vías de abordaje y ángulos de entrada a la pared anteroinferior se observan en la Fig. 6.

Fig. 6. Vías de abordaje y los ángulos de entrada a la pared anteroinferior del TV. A. Vista axial. B, Vista sagital
A la pared anteroinferior del TV y regiones vecinas se puede llegar desde un ángulo anterior, anterolateral y lateral, Con un ángulo anterior se puede abordar la pared anteroinferior del TV, los espacios interóptico-quiasmático e interópticocarotídeo, la región selar-supraselar y el seno esfenoidal. Las vías de abordaje que siguen una vista o ángulo anterior son la vía transeptoesfenoidal y la subfrontal.
La vía transeptoesfenoidal está indicada en todos los tumores de la región selar y supraselar que comprometan la pared anteroinferior del TV respetando las siguientes condiciones: el eje mayor del tumor debe coincidir con el eje de la vía de abordaje, la silla turca debe estar agrandada y el seno esfenoidal neumatizado u ocupado por tumor17,37,51, La exéresis tumoral está limitada al vaciamiento intracapsular, y en el caso que la cápsula descienda al campo operatorio la disección de la misma de estructuras neurovasculares no se realiza bajo visión directa, Las posibles complicaciones de la vía son: defecto cosmético nasolabial, insuficiencia ventilatoria nasal, lesión del nervio infraorbitario y de la mucosa olfatoria, fractura de base de cráneo, lesión de los pares craneanos del 1 al 6, lesión hipotalámica y del polígono de Willis, fistula de LCR, Existen trabajos17,26 sobre resección de creaneofaringiomas por vía transeptoesfenoidal; pero dada la anatomía y biología de estos tumores2,59 es preferible intentar primero una exéresis por vía alta ante la sospecha clínico-radiológica, porque resulta dificultosa la disección debido a las fuertes adherencias que posee y a la presencia de calcificaciones y la relación con vasos perforan-tes de la aCI y aComP50. La curación es mediante la exéresis total59.
La vía subfrontal está indicada en los tumores que comprometen la pared anteroinferior del TV y que no son accesibles a una vía transeptoesfenoidal porque el seno no está neumatizado o la silla turca es pequeña. La vía subfrontal requiere de una craneotomía frontal uni o bilateral, en este caso se liga el seno longitudinal superior y se secciona la hoz del cerebro en la base de la fosa anterior, La exposición se continúa con la reclinación del lóbulo frontal hasta visualizar los nervios olfatorio, óptico, quiasma y el complejo de la arteria comunicante anterior. Mediante una vía subfrontal se accede a un abordaje translámina terminalis, al espacio interóptico-quiasmático e interóptico-carotídeo principalmente.
Las vías de abordaje frontotemporal y subtemporal aportarán una visión anterolateral y lateral respectivamente sobre las regiones selar, supra selar y anteroinferior del TV. La de mayor uso en la actualidad es la frontotemporal, que se realiza mediante una craneotomía pterional56,58; pudiendo ampliarla a temporal para la vía de abordaje subtemporal utilizada por Symon y colaboradores50. La vía frontotemporal es muy versátil y permite el acceso al TV mediante los abordajes translámina terminalis, óptico-quiasmático o sub quiasmático, óptico-carotídeo, carótido-tentorial; y también al dorso selar, clivus y región prepeduncular58. También puede combinarse con las vías transcallosa, transfrontal y transeptoesfenoidal,
Luego de la craneotomía pterional se exponen los lóbulos frontal y temporal y se abre el valle silviano lo que permite una mayor reclinación de los mismos y aumenta la exposición, El centro de la vía de abordaje es el triángulo óptico-carotídeo, aunque también se podrán explorar los otros espacios paraquiasmáticos.
La vía subtemporal requiere una craneotomía pterional ampliada a temporal, luego se eleva la punta del lóbulo temporal exponiendo el borde libre del tentorio y así, se aborda el TV, región selar-supraselar y las caras anterior y lateral del mesencéfalo mediante una visión más lateral e inferior respecto de las otras vías. La entrada al TV puede hacerse a través del piso siempre que el mismo esté reducido a una membrana glial producto de la compresión crónica de un tumor que lo desplazó lateralmente.
Abordaje translámina terminalis (Fig. 7)
Está indicado en las lesiones que ocupan la porción anteroinferior de la luz del TV, especialmente aquellos de origen supraselar (craneofaringiomas) con un importante componente retroquiasmático preinfundibular; también en los casos de quiasma prefijado porque está limitado el acceso subquiasmático31,49.

Fig 7. Abordaje translámina terminalis. Modificado de Rhoton y col.37.
Una vez en la región quiasmática se abre la aracnoides de la cisterna quiasmática y de la lámina terminalis; si la arteria comunicante anterior es larga y bloquea el acceso, se la puede seccionar49. A menudo el tumor protruye a través de la lámina terminalis, si el tumor es intraventricular la apertura de la misma lo expondrá38 en cambio, si el tumor es supraselar retroquiasmático y voluminoso la apertura de la lámina terminalis se acompañará de la apertura del piso del TV, es decir el hipotálamo, porque se encuentra distendido, elevado y aplicado contra la cara posterior de la lámina terminalis.
Shucart45 aconseja explorar siempre el área del receso infundibular, porque es el sitio más común en donde asientan los residuos tumorales (especialmente craneofaringiomas), punto de origen de las recidivas.
Las posibles complicaciones del abordaje translámina terminalis son: lesión de los pares 1 y 2, quiasma y tractos ópticos, hipotálamo, comisura anterior, fórnix, rostro y pico del cuerpo calloso, y complejo de la arteria comunicante anterior, aB y aCP.
Abordaje interóptico-quiasmático (Fig, 8)
Está indicado en los tumores de la región selarsupraselar que comprometen la pared anteroinferior del TV. Una vez en la región quiasmática se incide la aracnoides y se aborda el tumor entre los nervios ópticos y el quiasma, teniendo en cuenta que la movilización de los mismos debe ser mínima porque se incrementará el déficit visual.
El quiasma está normofijado en un 70% de los casos, retrofijado en un 15% y prefijado también en un 15%36. La presencia de un quiasma prefijado limita la exposición al espacio subquiasmático por lo que se puede considerar la vía de abordaje subfrontal-transesfenoidal31, que mediante la remoción del plano esfenoidal, tubérculo selar y la pared anterior de la silla turca aumentará el espacio subquiasmático a expensas del seno esfenoidal (Fig, 9). Finalizada la cirugía se debe sellar el mismo para prevenir la craneorrinorrea, Esta vía está indicada en los tumores selares-supraselares con o sin invasión al seno esfenoidal y quiasma prefijado.

Fig 8. Abordaje interóptico - quiasmático. Modificado de Rhoton y col.37

Fig. 9.Vía de abordaje subfrontal transes fenoidal. Modificado de Rhoton y col.37

Fig. 10. Abordaje interóptico carotídeo, Modificado de Rhoton y col.37
Abordaje óptico-carotídeo (Fig. 10)
Se realiza a través del triángulo óptico-carotídeo limitado por el nervio óptico por dentro, la aCI por fuera y la arteria cerebral anterior (Al) por arriba. Está indicado en los tumores selares-supraselares con proyección superolateral y que ensanchan el espacio óptico-carotídeo, Este abordaje se puede realizar mediante las vías de abordaje subfrontal, frontotemporal y subtemporal, y se puede combinar con los abordajes subquiasmático, translámina terminalis y carótido-tentorial. Muy delicadas deben ser las maniobras sobre el nervio óptico y la aCI, además de preservar las perforantes carotídeas al nervio óptico y al complejo infundíbulo-hipofisiario; como así también, las de la aComP que van al hipotálamo.

Fig. 11. Abordaje carótido-tentorial. Modificado de Rho-ton y col.37
Abordaje carótido-tentorial o retrocarotídeo (Fig. 11)
Está limitado por la aCI por dentro, el borde tentorial por fuera y el III par craneal por detrás. Está indicado en los tumores selares-supraselares con proyección posterolateral principalmente. Este abordaje necesita de las vías frontotemporal y/o subtemporal.
B) Abordajes a través del techo
Están indicados en las lesiones de la porción anterosuperior, con extensión a uno o ambos ventrículos laterales, tercio medio y posterior del TV excluyendo la patología de la región pineal. Las lesiones más frecuentes abordadas por el techo son el quiste coloideo, gliomas de tálamo y cisticercosis intraventricular en áreas endémicas. La hipertensión endocraneana por hidrocefalia obstructiva es el cuadro clínico más frecuente,
Controvertida ha sido la bibliografía en atribuir la responsabilidad de los trastornos de memoria e intelectuales a la sección del cuerpo calloso en las cirugías del TV. Si bien en la actualidad se atribuye que dichos déficit son causados por la sección uni o bilateral del fórnix, existen algunos indicios de trastornos en la información interhemisférica cuando se realizan callosotomías parciales54. Generalmente las alteraciones secundarias a una callosotomía parcial pasan desapercibidas para el propio paciente y solo son apreciadas en pruebas exploratorias específicas. Clásicamente se describen desórdenes en la transferencia visuoespacial, táctil y aprendizaje de tareas motoras bimanuales.
Apuzzo y colaboradores5 no han hallado en los postoperatorios de sus pacientes trastornos somatoestésicos o de información motora si se realiza una sección de hasta 2,5 cm en la porción anterior del cuerpo calloso.
Tradicionalmente se realizaba la sección uni o bilateral del fórnix con el objeto de ampliar el agujero de Monro; actualmente la mayoría de los autores coinciden en respetar la integridad del mismo, aunque hoy algunos recomiendan la fornicectomía en caso de necesidad siempre y cuando sea unilateral37. El papel del fórnix en el proceso de memoria está ampliamente aceptado; como así también, la participación de las estructuras que conecta es decir, el hipocampo y los cuerpos mamilares. Numerosos trabajos existen sobre la repercusión en la memoria luego de la sección del fórnix; básicamente con la movilización de ambos y la sección unilateral provocará amnesia para los hechos recientes generalmente transitoria, en cambio la sección bilateral la amnesia será definitivas.
Lavyne y Patterson25 aconsejan no realizar fornicectomía ni la aspiración del tubérculo anterior del tálamo (ambos son recursos para agrandar el agujero de Monto) propuesto por Ehni15 en los pacientes con déficit preoperatorio de la memoria porque al hacerlo se interrumpe el circuito de Papez: hipocampo-alveusfimbria-fórnix-tubérculos mamilares-haz mamilotalámico-núcleo anterior del tálamo- circunvolución del cuerpo calloso; y así, los trastornos mnésicos podrían agravarse.
Las vías de abordaje transcerebral-transventricular tienen indicaciones precisas; a pesar de ello, Yasargil y colaboradores59 prefieren no utilizarla por la posibilidad de desarrollar epilepsia y porencefalia postoperatoria; en cambio Rhoton y colaboradores37 la aconsejan cuando se plantea un abordaje subcoroideo, por tener una visión más lateral e inferior que la vía transcallosa.
Vía de abordaje transcallosa anterior
Indicada en los tumores ubicados en la posición anterosuperior del TV con proyección a uno o ambos ventrículos laterales, tercio medio y posterior. Tiene la ventaja de acceder a los ventrículos laterales y TV sin la necesidad de realizar corticotomías sin que exista hidrocefalia37.
La craneotomía generalmente trapezoidal con base en la línea media, está centrada en la sutura coronal (2/3 por delante y 1 /3 por detrás). Apuzzo y colaboradores5 en base a la disposición de las venas corticales que drenan al seno longitudinal superior observadas en angiografía o resonancia varían la localización de la craneotomía en sentido anteroposterior. Luego de abrir la duramadre se reclina el hemisferio cerebral (generalmente derecho) hasta exponer el cuerpo calloso. Se identifican las arterias pericallosas y se las diseca para movilizarlas, La sección del cuerpo calloso (medial o parasagital) no debe exceder los 2,5 a 3 cm de longitud comenzando desde la rodilla hacia atrás, tomando en cuenta que el agujero de Monro se encuentra aproximadamente en el trayecto de una línea imaginaria que se extiende desde la sutura coronal hasta el conducto auditivo externo.
Cuando la callosotomía es medial se entrará al cavum del septum pellucidum (se lo identifica fácilmente por carecer de LCR, plexo coroideo y venas subependimarias), avanzando en la disección por línea media se arribará al rafe interforniceal; en cambio, si se atraviesa la hoja del septum se entrará al ventrículo lateral. Una vez en el ventrículo lateral se identifica el plexo coroideo y se lo sigue hasta su extremo anterior donde confluye la vTE por fuera; este punto de convergencia coincide con el borde posterior del agujero de Monro. Siempre el plexo coroideo es medial y la vTE lateral; se debe tener presente esta relación para diferenciar si se entró al ventrículo lateral derecho o izquierdo. Si al finalizar la cirugía se cree que el TV no ha sido desbloqueado se puede realizar una amplia fenestración en el septum pelllucidum comunicando ambos ventrículos laterales, permitiendo si se quiere una sola derivación. Este procedimiento también es aplicable a la vía transcerebral-transventricular.
La vía transcallosa anterior permite realizar un abordaje interforniceal siguiendo estrictamente la línea media, ose podrá realizar un abordaje lateral al techo como el transforaminal o a la fisura coroidea.
Vía de abordaje transcallosa posterior
Prácticamente no se utiliza como abordaje al TV porque implicaría la sección de la comisura hipocámpica provocando amnesia definitiva.
Vías de abordaje transcerebral-transventricular
Pueden ser frontal, parietal y temporal. Esta última, o vía de Van Wagenen52 está destinada a las lesiones de la pared posterior. En general, las vías transventriculares se ven favorecidas ante la presencia de hidrocefalia.
La vía transventricular frontal está especialmente indicada en las lesiones que ocupan la porción anterosuperior y tercio medio del TV, y en particular a aquellas que se extienden a través del agujero de Monro al ventrículo lateral del lado en que la lesión es abordada. La craneotomía frontal está centrada en F2, se realiza una corticotomía de 4 cm en sentido anteroposterior y se profundiza la disección hasta penetrar el ventrículo lateral37. Una vez dentro, se reconocen las estructuras intraventriculares y se debe evitar la colocación de espátulas en la pared lateral frente al agujero de Monro, porque a este nivel se encuentra la rodilla de la cápsula interna en una situación subependimaria.
La vía transventricular parietal está indicada en las lesiones del TV con extensión al atrio ventricular y tálamo. La corticotomía se realiza en la circunvolución parietal superior evitando así, la lesión de la vía visual y el área del lenguaje. La entrada ventricular es a nivel del atrio y por esta vía se expone el tercio posterior del TV y su pared posterior.
Abordaje medial al techo o interforniceal (Fig. 12)
Actualizado y popularizado por Apuzzo quien lo utiliza para la totalidad de las lesiones del TV. La maniobra interforniceal fue originalmente descripta por Busch8 en 1944, y Baldwin7 en 1963 sugirió la vía completa transcallosa-interforniceal en laboratorio4.
La vía transcallosa anterior ofrece el mejor campo para el abordaje interforniceal, porque se continúa la disección por la línea media comenzada en el cuerpo calloso. Este abordaje elimina la necesidad de seccionar el fórnix, vTE o resecar el tubérculo anterior del tálamo para agrandar el agujero de Monro. El abordaje interforniceal puede realizarse fácilmente si luego de la callosotomía se entra al cavum del septum pelllucidum. Generalmente la presencia de un tumor con cierto volumen separa en alguna porción a los fórnices facilitando la entrada al rafe interforniceal. La apertura del rafe comienza detrás del agujero de Monro y no debe exceder los 20 mm por la posibilidad de lesión de la comisura hipocámpica.

Fig. 12. Abordaje medial al techo o interforniceal. A. Vista superior. B. Vista coronal. Moderado de Apuzzo3
Apuzzo y colaboradores5 concluyen que el abordaje interforniceal es una alternativa quirúrgica posible y asegura en el manejo de las lesiones tumorales y vasculares del TV, permitiendo una visualización de toda la cavidad ventricular y con mínimas consecuencias (generalmente trastornos transitorios en la memoria reciente).
Abordajes laterales al techo (Fig. 13)
El espacio comprendido entre el tálamo y el fórnix a nivel del cuerpo de los ventrículos laterales corresponde al borde lateral del techo del TV. El l/3 anterior de dicho espacio tiene una separación mayor y delimita el agujero de Monro, en cambio los 2/3 posteriores delimitan un espacio muy estrecho y corresponde a la porción corporal de la fisura coroidea donde se inserta el plexo coroideo. Así, los abordajes laterales al techo pueden ser: transforaminales si se realizan a través del agujero de Monro, supracoroideo y subcoroideo si se realizan a través de la fisura coroidea por arriba o por debajo del plexo coroideo respectivamente; por último, el abordaje transforniceal. Los abordajes laterales pueden ser realizados mediante las vías de abordaje transventricular frontal y transcallosa anterior. Esta cuenta con la ventaja de explorar a ambos lados por ser medial, en cambio pocas veces se podrá explorar completamente el espacio intertálamo-forniceal contralateral por vías de abordaje transventricular frontal y transcallosa anterior.

Fig. 13. Abordajes laterales al techo. Vista del ventrículo lateral derecho, (Modificado de Apuzzo4).
Abordaje transforaminal
Muy útil en los tumores del TV que atraviesan el agujero de Monro. Frecuentemente el agujero está agrandado por el tumor y/o hidrocefalia lo que facilita el abordaje. Cuando el agujero es pequeño existen tres opciones para agrandarlo y así aumentar la exposición al TC.
1° Fornicectomía: es la sección del pilar anterior del fórnix por delante del agujero de Monro y por debajo de la vena septal anterior. Si bien en la actualidad la mayoría de los autores la desaconsejan por los trastornos mnésicos; Rho-ton y colaboradores37 entre otros la recomiendan a condición de no realizarla en forma bilateral. Ehni15 concluye que la fornicectomía unilateral puede no tener trastornos evidenciables en muchas ocasiones, pero nunca se está seguro que el fórnix contralateral esté afectado por el tumor que se va a resecar.
2° Sección de la vTE: este procedimiento se describió como alternativa a la fornicectomía18. La sección se realiza a nivel del borde posterior del agujero de Monro y se complementa en caso de ser necesario con una apertura subcoroidea; de esta manera se eleva el plexo coroideo que arrastra a su vez al techo (fórnix más tela coroidea), aumentando aún más la exposición. Así, mediante esta maniobra, se desinserta el techo de la pared lateral comunicando el agujero de Monro con la fisura coroidea.
La sección de la vTE puede cursar en forma asintomática; aunque se ha descripto somnolencia, hemiplejia, mutismo por infarto hemorrágico de los ganglios basales18. Lavyne y Patterson25 aconsejan la sección de la vTE siempre y cuando exista en la angiografía preoperatoria una vena directa lateral importante que asegure el drenaje venoso de los ganglios basales.
3° Remoción del núcleo anterior del tálamo: el borde anteroinferior del agujero de Monro está ocupado por el tubérculo anterior del tálamo en cuyo interior están los núcleos anteriores. La remoción de ellos propuesto por Ehni15 representa otra alternativa a la fornicectomía en función de agrandar el agujero de Monro. Esta remoción es cuestionada por Lavyne y Patterson25, porque los núcleos anteriores forman parte del circuito de Papez y por tanto podrían agravarse los trastornos mnésicos preexistentes.
Abordaje a la fisura coroidea
1) Subcoroideo: descripto casi simultáneamente por Delandsheer y colaboradores13, y Sehrbundt Viale y colaboradores42 en 1978, quienes lo denominaron abordaje intertálamo-trigonal y subcoroideo respectivamente53. Resulta útil en las lesiones ubicadas detrás del agujero de Monro yen especial si están próximas al techo, ya que se obtiene una amplia exposición del tercio medio del TV.
El abordaje subcoroideo puede realizarse a partir de una vía de abordaje transcallosa anterior o transventricular frontal, aunque Rhoton y colaboradores37 aconseja la segunda porque al entrar más lateral e inferior mejora el ángulo de visión. Una vez en el ventrículo lateral se identifica el agujero de Monro, plexo coroideo y vTE. El área de trabajo está por detrás de la misma y debajo del plexo coroideo; este es el abordaje subcoroideo estricto descripto por Viale; en cambio Delandsheer13 y Hirsch18 por separado preconizan la sección de la vTE uniendo así el abordaje subcoroideo al transforaminal25. Luego de elevar el plexo coroideo (envuelto por la tela coroidea), se liberan las adherencias laxas entre la tela coroidea y el epéndimo que cubre al tálamo, pudiendo a veces encontrar alguna vena o arteriola que puede ser sacrificada sin problema11,53. Así se arriba a la luz del TV desplazando hacia arriba y adentro el plexo coroideo, fórnix y los elementos que transcurren por la tela coroidea (vCI y aCoPM). De esta manera el cirujano podrá trabajar a través de dos aberturas: una anterior, natural, que corresponde al agujero de Monro; y una posterior, artificial, que corresponde a la fisura coroidea abierta por debajo del plexo coroideo. A veces la vena directa lateral, que transcurre por detrás de la vTE y desemboca en la vCI, puede limitar la apertura subcoroidea. Es necesario recordar que la vena directa lateral no siempre es un vaso insignificante y a veces es más importante que la vTE, debiendo valorar correctamente me diante la angiografía preoperatoria y la visión quirúrgica a fin de elegir la vena a sacrificar para ganar espacio en caso de ser necesario.
2) Supracoroideo: indicado prácticamente en las lesiones vasculares cuyos vasos nutricios provienen de la tela coroidea. La disección comienza por arriba del plexo coroideo justo en el límite con el fórnix accediendo rápidamente a la tela coroidea (hoja superior), y a través de ésta a su contenido.
Abordaje transforniceal
Poco utilizado, expone el tercio posterior del techo a nivel de la anastomosis de ambas vCI. Luego de realizar una vía transventricular parietal se expone el atrio ventricular. Se identifica el plexo coroideo que está por dentro del tálamo y por debajo del cuerpo calloso, entre éste y el plexo coroideo se ubica el cuerpo y pilar posterior del fórnix. Se lo incide en dirección a sus fibras hasta llegar a la tela coroidea, sin comprometer la comisura hipocámpica ni el fórnix contralateral. Al entrar a la tela coroidea se desplaza hacia el lado opuesto las vCI, vGA y la aCoPM; exponiendo así, el tercio posterior y la pared posterior del TV.
C) Abordajes a través de la pared posterior
Las lesiones del tercio posterior y la pared posterior del TV se agrupan genéricamente en la patología de la región pineal. Los tumores pineales son por lejos la patología más frecuente de la región, el resto está repartido entre los tumores de tálamo, esplenio del cuerpo calloso, cerebelo, ten-torio que invaden secundariamente la región. Los tumores pineales comprenden del 0.4 al 1% de los tumores endocraneanos en series americanas y europeas, ascendiendo al 5% en el Japón, desconociéndose el motivo de ello44.
La región pineal tradicionalmente fue considerada dificultosa y peligrosa para abordar, debido a la distancia que la separa de la duramadre y la compleja red venosa que la rodea. El manejo de los tumores fue siempre controvertido y ha cambiado a lo largo del tiempo. En el pasado se indicaba la operación paliativa o derivación ventricular seguida de radioterapia, basado en la alta morbimortalidad operatoria de esa época sumado a que el 70% de los tumores son radiosensibles29. El esquema derivación más radioterapia aportó resultados satisfactorios con una tasa de mortalidad menor al 5% y una sobrevida a los 5 años del 60 al 75% (85% para los germinomas) versus una mortalidad operatoria del 30 al 70% y una morbilidad de más del 65% en las primeras décadas del siglo XX22.
A partir de la década del 70 Stein46 y Jamieson20 por separado comenzaron sus comunicaciones con resultados promisorios. En la actualidad con los avances anestésicos, diagnósticos y de técnica microquirúrgica se ha reducido la tasa de mortalidad operatoria a menos del 5%. La ventaja evidente de la cirugía es sobre el 30% de los tumores pineales que se caracterizan por ser benignos, encapsulados y radiorresistentes47.
Dada la diversidad de tumores y la baja morbimortalidad operatoria actual asociado a los daños de la radioterapia en niños, Edwards y colaboradores14 aconsejan conocer primero la histología del tumor en todos los casos antes de planificar el tratamiento definitivo.
Actualmente existen dos alternativas terapéuticas a la cirugía convencional. La primera basada en la radiosensibilidad de los germinomas (60% de los tumores pineales) aplica primero 2000 Rads sobre el tumor y si en la TAC de cerebro con contraste postradioterapia se reduce significativamente el volumen tumoral, se entiende que es un germinoma y se completa hasta los 5000 Rads. Esta alternativa es la llamada biopsia biológica positiva; en caso de ser negativa se indica de cirugía convencional. La segunda alternativa es realizar primero una biopsia estereotáxica y de acuerdo al tipo de tumor se elabora el plan terapéutico. Esta modalidad encuentra cierta resistencia en los neurocirujanos más agresivos debido a las posibles complicaciones de la biopsia: hemorragia, altamente peligrosa en esta región y la potencial aparición de implantes metastásicos a lo largo del trayecto de la aguja-tracker35.
Los tumores más frecuentes son el germinoma (60%), teratomas malignos (15%), tumores derivados de las células pineales (10-15%) y el resto está repartido entre gliomas de tálamo, teratomas benignos, meningiomas, etc. Los teratomas malignos y pineoblastomas deberían operarse lo antes posible porque la respuesta a la radioterapia es poco satisfactoria.
La mayoría de los pacientes con tumores pineales se presentan con hidrocefalia por obstrucción del acueducto, pero el hallazgo característico es el síndrome de Parinaud.
Luego de hacer el diagnóstico de tumor de la región pineal basado en la clínica, radiología, marcadores tumorales en sangre y LCR se planificará el abordaje. Las vías más utilizadas en la actualidad son la occipital transtentorial y la supracerebelosa infratentorial. La vía se elegirá de acuerdo a la localización y proyección tumoral, y además pesará sobre la elección el conocimiento y experiencia que el neurocirujano tenga sobre una u otra vía.

Fig. 14. Vía de abordaje suboccipital transtentoríal. Modificado de Rhoton y col.31
Vía de abordaje occipital transtentorial (Fig. 14)
La vía fue originalmente propuesta por Horrax19 y luego modificada por Poppen32 en 1966 y Jamieson20 en 1971, se la conoce por vía de Poppen. Está indicada en los tumores de la región pineal, especialmente en aquellos centrados o ubicados por arriba del borde tentorial con escasa extensión a la fosa posterior o al lado opuesto del abordaje. Una desventaja de esta vía es que la vGa y tributarias a menudo obstruyen el abordaje, además no provee adecuada visualización de la mitad contralateral del tálamo y la placa cuadrigeminal.
En la actualidad la vía occipital transtentorial se realiza de acuerdo a la descripción de Clark10. El paciente se coloca en posición de banco de plaza (derecha abajo) con un decúbito intermedio (entre lateral y ventral). Otra posición alternativa es sentado con la cabeza ligeramente inclinada a la derecha27.
Se aborda por craneotomía occipital "derecha" bien basal y medial hasta exponer el seno longitudinal superior, tórcula y seno lateral derecho; el lóbulo occipital derecho cae por gravedad al estar debajo de la hoz y se elimina la necesidad de usar espátula disminuyendo la posibilidad de daño a la corteza visual. El tentorio se divide por fuera y paralelo al seno recto hasta el borde libre, la vGa y tributarias aparecerán en el campo siempre por arriba de la región pineal. El esplenio estará por arriba y a veces elevado por el tumor; vermis superior, placa cuadrigeminal, IV par homolateral, aCeS y la vena cerebelosa precentral por debajo del tumor, la vbR ipsilateral, aCoPM, aCP y el tálamo estarán por fuera.
Vía de abordaje supracerebelosa infratentorial (Fig. 15)
Inicialmente utilizada por Horsley en 1910, descripta por Krause24 en 1926, modificada y popularizada por Stein46,48 en 1971. Está indicada en los tumores de región pineal, especialmente aquéllos que crecen hacia el TV y la fosa posterior. La exposición está limitada por arriba del tentorio y en especial a nivel paramediano en la región posterior del TV48.
Reid y Clark33 comparan esta vía con la occipital transtentorial afirmando que la lesión está alojada profundamente y la red venosa aparece al final de la cirugía, por ello la ventaja es la vía supracerebelosa. Una desventaja es la posibilidad de embolia gaseosa; además, es poco confortable para el cirujano y ayudante6.
El paciente se coloca "sentado" y se realiza una craniectomía suboccipital medial alta que exponga la tórcula y ambos senos laterales, el acceso a la región pineal es entre la superficie superior del cerebelo y la inferior del tentorio. La vGa y ambas vCl están por arriba, la vena cerebelosa precentral está por detrás y en la línea media; tálamo, aCoPM, aCP y vbR por fuera; por último, la placa cuadrigeminal, nervio troclear, aCeS y el vermis superior por abajo.
Sekhar y Goel43 recientemente describieron un abordaje que combina la vía occipital transtentorial y la supracerebelosa infratentorial con sección del seno lateral y posterior anastomosis al finalizar la cirugía. Estos autores la sugieren para grandes tumores y malformaciones vasculares que se extienden por arriba y debajo del hiato tentorial.

Fig. 15.Vía de abordaje supracerebeloso infratenlorial. Modificado de Rhoton y col.31
Vía de abordaje transcallosa posterior
Actualmente en desuso para las lesiones de la región pineal sólo está indicada cuando el tumor compromete además el esplenio del cuerpo calloso. Esta antigua vía de abordaje o vía de Dandy secciona el esplenio del cuerpo calloso para luego observar a ambos fórnices (pilares posteriores y comisura hipocámpica) y la vGa que se interponen con la glándula pineal.
En caso de lesiones pequeñas Yasargil y colaboradores57 recomiendan la sección transversal del esplenio siguiendo la dirección de sus fibras, lo cual evita la lesión de fibras comisurales que conectan las áreas primarias y secundarias visuales.
Las vías transventricular temporal de Van Wagenen52 descripta en 1931 y la subtemporal posterior no tienen indicación en la actualidad.
CIRUGÍA MÍNIMAMENTE INVASIVA DEL TERCER VENTRÍCULO
La ventriculoscopia simple, utilizada por Dandy en 1922 y en nuestro país por Orlando41 en 1931, permitió el desarrollo de técnicas altamente sofisticadas y utilizadas en la actualidad para la exploración del TV y ventrículos laterales fundamentalmente. Entre estas técnicas se encuentra el desarrollo de los equipos endoscópicos de diámetro reducido pudiendo realizar biopsias, aspiración de quistes, hemostasia con pinzas de coagulación o láser e implantación de material radioactivo. También la estereotaxia guiada por TAC, IRM y angiografía digital permite la aproximación a la lesión en forma precisa y segura. En la actualidad la cirugía mínimamente invasiva combina los principios de la estereotaxia, neuroimágenes, computación, técnicas microquirúrgicas, óptica, creando una nueva dimensión en el manejo de los procesos endocraneanos.
Apuzzo3 con amplia experiencia en la cirugía convencional del TV enfatiza las ventajas del abordaje estereotáctico. Utilizó en más de 750 procedimientos el sistema de Brown-RobertsWells, correspondiendo 150 lesiones del TV. Remarca que el acceso es rápido (60 minutos) y seguro. Mediante esta modalidad realizó determinaciones histológicas y microbiológicas, aspiración de quistes y abscesos, instalación de sistemas de drenaje, colocación de fuentes radioactivas, cerebroscopia y ventriculoscopia con biopsia, aspiración y escisión. Los objetivos se cumplieron en un 97%, con biopsias positivas en un 95%; la morbilidad fue menor al l%, al igual que la mortalidad, La craneotomía posterior fue indicada o requerida en menos del 20%.
Apuzzo finalmente concluye que este método es uno más en el manejo de las lesiones del TV. Conocer la histología en las lesiones intraaxiales pueden ser drenadas bajo control preciso y dejar sistemas de drenaje o fuentes radioactivas. Los quistes intraventriculares pueden ser aspirados bajo visualización endoscópica y resecados totalmente.
Recientemente Morita y Kelly30 publicaron su trabajo acerca de la técnica estereotáxica volumétrica asistida por computadora, su experiencia asciende a 60 procedimientos en 58 pacientes. La patología fue muy variada, y accedieron completamente a los ventrículos laterales y tercio anterior del TC. La técnica consiste en abordar el ventrículo lateral mediante una corticotomía utilizando un espéculo cilíndrico de 2 a 3 cm de diámetro fijado a un marco y guiado por computación, combinando técnicas estereotácticas y microquirúrgicas. El tamaño de la craneotomía no supera los 4 o 5 cm y el de la corticotomía los 2 o 3 cm, a través del espéculo pasa el instrumental, cánulas de aspiración y el sistema láser con CO2.
La mortalidad quirúrgica fue de 3,4% y las complicaciones postoperatorias en los tumores del TV fueron: trastornos mnésicos definitivos (2 casos), transitorios (2 casos), trastornos de la conciencia (2 casos), hidrocefalia aguda (2 casos), secreción inadecuada de ADH (1 caso), higroma subdural (l caso) y convulsiones (2 casos).
Los autores concluyen que esta técnica utiliza un trayecto seguro y evita el daño de corteza y vías subcorticales elocuentes. Puede realizarse con ventrículos pequeños y resecar tumores con un diámetro mayor al espéculo a través de movimientos coordinados del mismo; cabe destacar que el diámetro del espéculo provee adecuado espacio de trabajo con mínima compresión cerebral. Una desventaja significativa es que no puede utilizarse en las grandes fisuras; por ejemplo, la interhemisférica para la vía transcallosa, o la vía subfrontal en el abordaje translámina terminalis.
CONCLUSIÓN
Las lesiones ubicadas en la región del TC son las más dificultosas de exponer y resecar, y el abordaje a la cavidad o alguna de sus paredes implica la sección de estructuras nerviosas y vasculares. Esta lesión neurovascular producto del abordaje junto al daño local secundario a la exéresis de la lesión ha marcado la evolutividad de la cirugía del TV durante este siglo. Los malos resultados en los primeros abordajes determinó por un lado conductas conservadoras o menos agresivas; otros en cambio, perfeccionaron el manejo de estas lesiones ampliando sus conocimientos en anatomía, fisiología, clínica neurológica y neuroquirúrgica, radiología y microtécnicas quirúrgicas permitiendo en la actualidad cirugías regladas con baja morbimortalidad operatoria.
En la presente revisión se propone una clasificación de abordajes ya conocidos al TV basada en la localización de la lesión y en la pared ventricular implicada en el mismo. Así, los abordajes al TV pueden ser a la pared anteroinferior, pared superior o techo y a la pared superior.
A) Los abordajes a la pared anteroinferior se los divide en translámina terminalis, al espacio subquiasmático, al espacio óptico-carotídeo y al espacio carótido-tentorial. El abordaje translámina terminalis está indicado en las lesiones supraselares con crecimiento anterior y superior, y que la pared inferior se aplique detrás de la pared anterior del TV; el ejemplo típico es el craneofaringioma.
El abordaje al espacio subquiasmático es preferible hacerlo desde una vista anterior mediante una vía subfrontal. Si el quiasma está normo o retrofijado el espacio será suficiente para explorarlo, en cambio si está prefijado se utiliza la vía subfrontal transesfenoidal que reseca el tubérculo selar, plano esfenoidal y pared anterior de la silla turca aumentando el espacio interópticoquiasmático o subquiasmático a expensas del seno esfenoidal.
Los abordajes óptico-carotideo y carótido-tentorial se realizan mejor desde una vista anterolateral y lateral mediante una vía frontotemporal y subtemporal respectivamente, estos abordajes se indican cuando el tumor tiene proyección hacia la región paraselar y fosa media generalmente,
Cuando la lesión es intraselar y comprime secundariamente la pared anteroinferior del TV puede ser abordado mediante una vía transeptoesfenoidal. Para efectuarla es necesario que, el eje mayor del tumor coincida con el eje de al vía, exista una silla turca agrandada y un seno esfenoidal neumatizado.
B) Los abordajes al techo están indicados cuando las lesiones ocupan la porción superior del TV. El abordaje interforniceal requiere una vía transcallosa anterior pudiendo explorar la totalidad de la cámara tercerventricular.
Los abordajes entre el tálamo y el fórnix pueden efectivizarse mediante las vías transcallosa y transcerebral transventricular. La entrada al TV es a través del agujero de Monro o la fisura coroidea (supra y subcoroideo). Las lesiones del tercio anterior con extensión al ventrículo lateral que agrandan el agujero de Monro pueden abordarse en forma transforaminal; si el agujero es normal puede agrandarse mediante la sección del pilar anterior del fórnix, ligadura y sección de la vTE o la aspiración del tubérculo anterior del tálamo.
El abordaje subcoroideo permite explorar el tercio medio y gran parte del posterior abriendo la brecha entre el plexo coroideo y el tálamo. Las lesiones vasculares del techo se acceden mejor desde un abordaje supracoroideo (entre el plexo coroideo y el fórnix).
C) Los abordajes a la pared posterior están generalmente indicados a la patología de la región pineal. La vía transcallosa posterior se utiliza cuando el tumor crece hacia el esplenio o viceversa. La vía transventricular posterior cuando el tumor crece hacia el pulvinar y el atrio ventricular.
La vía suboccipital transtentorial es para los tumores pineales con un mayor componente hacia el pulvinar o por arriba del tentorio, en cambio la vía supracerebelosa infratentorial cuando el mayor componente está por debajo del tentorio o compromete el vermis.
La cirugía mínimamente invasiva reduce las exposiciones, el daño neurovascular es mínimo con abordajes precisos y seguros basado en técnicas microquirúrgicas y estereotácticas, óptica y computación.
Todos los abordajes son posibles y seguros. Es necesario y fundamental conocer la anatomía microquirúrgica del TV y de las regiones por donde transcurre el abordaje. Los estudios neurorradiológicos actuales brindan información acerca de la localización, proyección y tipo de lesión; como así también, el estado de las estructuras neurovasculares regionales (compresión, desplazamiento e infiltración).
De los conocimientos anatómicos, fisiológicos, clínico y radiológico el neurocirujano deberá elaborar la estrategia quirúrgica que más favorezca al paciente, conociendo los riesgos que implican cada uno de los abordajes al TV.
Bibliografía
1. Abe T, Sugishita M, Yatsuzuka S et al: Transcallosal interforniceal approach for a posteriorly projecting high basilar bifurcation aneurysm. J Neurosurg 78: 970-973, 1993.
2. Adamson TE, Wiestler OD, Kleihues P et al: Correlation of clinical and pathological features in surgically treated craniopharyngiomas. J Neurosurg 73: 12-17, 1990.
3. Apuzzo MLJ: Surgery of masses affecting the third ventricular chamber: techniques and strategies. Clin Neurosurg: 449-522, 1986.
4. Apuzzo MLJ: Transcallosal interforniceal exposure of lesion of the third ventricle. En: Operative neurosurgical techniques. Schmidek HH y Sweet WH. (ed). Grune & Stratton, Inc. 1988, pp 389-396.
5. Apuzzo MLJ, Chikovani OK, Gott PSet al: Transcallosal, interforniceal approaches for lesions affecting the third ventricle: surgical considerations and consequences. Neurosurgery 10: 547-554, 1982,
6. Ausman JI, Malik GM, Dujovny M et al: Threequarter prone approach to the pineal tentorial region. Surg Neurol 29: 298-306, 1988.
7. Baldwin M, Ommaya AK, Farrier R et al: Mesial cerebral incision. J Neurosurg 20: 679-686, 1963. Referido en Apuzzo (4).
8. Busch E: A new approach for the removal of tumors of the third ventricle. Acta Psychiatr Scand 19: 57-
60, 1944. Referido en Apuzzo (4).
9. Cambolat A, Onal C and Kris T: A hig-position basilar top aneurysm approached via third ventricle: Case report. Surg Neurol 39: 196-199, 1993.
10. Clark K: The occipital transtentorial approach to the pineal region. En: Operative neurosurgical techniques. Schmidek HH and Sweet WH. (ed). Grune & Stratton, Inc. 1988, pp 411-418.
11. Cossu M, Lubinu F, Orunesu G et al: Subchoroidal approach to the third ventricle. Surg Neurol 21: 325-331, 1984.
12. De los Reyes RA, Kantrowitz AB, Boehm FH et al: Transcallosal, transventricular approach to a basilar apex aneurysm.
Neurosurgery 31: 597-602, 1992,
13. Delandsheer JM, Guyot JF, Jomin M et al: Acces au troisieme ventricule par voie interthalamo-trigonale. Neurochirurgie 24: 419-422, 1978. Referido en Viale y Turtas (53).
14. Edwards MSB, Hudgins RJ, Wilson CB et al: Pineal region tumors in children. J Neurosurg 68: 989997, 1988.
15. Ehni G: Interhemispheric and percallosal (transcallosal) approach to the cingulate gyri, intraventricular shunt tubes, and certain deeply placed brain lesions. Neurosurgery 14: 99-110, 1984.
16. Geffen G, Walsh A, Simpson O et al: Comparison of the effects of transcortical and transcallosal removal of intraventricular tumours. Brain 103: 773788, 1980.
17. Hardy J: Transsphenoidal hypophisectomy. J Neurosurg 34: 582-594, 1971.
18. Hirsch JF, Zovaou A, Tlenier D et al: A new surgical approach to the ventricle with interruption of the striothalamic vein. Acta Neurochir (Wien) 47: 135147, 1979. Referido en Lavyne y Patterson (25).
19. Horrax G: Extirpation of a huge pinealoma from a patient with pubertas praecox: A new operative approach. Arch Neurol Psychiatry 37: 385-397, 1937. Referido en Jamieson (20).
20. Jamieson KG: Excision of pineal tumors. J Neurosurg 35: 550-553, 1971.
21. Jeeves MA, Simpson DA, Geffen G: Functional consequences of the transcallosal removal of intraventricular tumours. J Neurol Neurosurgery Psychiatry 42: 134-142, 1979.
22. Jooma R, Kendall B: Diagnosis and management of pineal tumors. J Neurosurg 58: 654-665, 1983.
23. Katayama Y, Tsubokawa T, Saijo M et al: Surgical management of cavernous malformations to the third ventricle. J Neurosurg 80: 64-72, 1994.
24. Krause F: Operative Freilegung der Vierhügel, nebst Beobachtungen über Himdruck und Dekompression. Zentralbl Chir 53: 2812-2819, 1926. Referido en Stein (48).
25. Lavyne MH, Patterson RH: Subchoroidal transvelum interpositum approach to mid-third ventricular tumors. Neurosurgery 12: 64-
72, 1983.
26. Laws ER Jr: Transsphenoidal microsurgery in the management of craniopharyngioma. J Neurosurg 52: 661-666, 1980.
27. Lazar ML, Clark WK: Direct surgical management of masses in the region of the vein of Galen. Surg Neurol 2: 17-21, 1974.
28. Long DM, Chou SN: Transcallosal removal of craniopharyngiomas within the third ventricle. J Neurosurg 39: 563-567, 1973.
29. Marsh WR, Laws ER Jr: Shunting and irradiation of pineal tumors. Clin Neurosurg 32: 384-396, 1985.
30. Morita A, Kekky PJ: Resection of intraventricular tumors via a computer-assisted volumetric stereotactic approach. Neurosurgery 32: 920-027, 1993.
31. Patterson RH, Danylevich A: Surgical removal of cranipharyngiomas by a transcranial approach through the lamina terminalis and sphenoid sinus. Neurosurgery 7: 11-117, 1980.
32. Poppen JL: The right occipital approach to a pinealoma. J Neurosurg 25: 706-710, 1966. Referido en Clark (10).
33. Reid WS, Clark WK: Comparison of the infratentorial and transtentorial approaches to the pineal region. Neurosurgery 3: 1-8, 1978.
34. Renfro M, Delashaw JB, Peters K et al: Anterior third ventricle meningioma in an adolescent: a case report. Neurosurgery 31: 746-750, 1992.
35. Rosenfeld JV, Murphy MA, Chow CW: Implanta tion metastasis of pineoblastoma after stereotactic biopsy. J Neurosurgery 73: 287-290, 1990.
36. Rhoton AL, Hardy DG, Chambers SM: Microsurgical anatomy and dissection of the sphenoid bone, cavernous sinus and sellar region. Surg Neurol 12: 63-104, 1979.
37. Rhoton AL, Yamamoto I, Peace DA: Microsurgery of the third ventricle: Part 2, Operative approaches. Neurosurgery 8: 357-373,
1981.
38. Schijman E: Abordaje trans-lámina terminalis. Correlación anátomo-quirúrgica. Comunicación personal. Hospital de Niños
"Ricardo Gutiérrez".
39. Schijman E, Monges J, Raimondi AJ et al: Choroid plexus papillomas of the III ventricle in childhood. Their diagnosis and surgical management. Child's Nerv Syst 6: 331-334, 1990.
40. Schijman E: Letter to the editor. Child's Brain 11: 349-352, 1984.
41. Schijman E: Vías de abordaje quirúrgico a las lesiones del tercer ventriculo. Tesis de doctorado Facultad de Medicina. UBA 1987.
42. Sehrbundt Viale E, Pau A: Approccio chirurgico al terzo ventricolo per via subcoroidea. S Sassaresi 56: 397, 1978. Referido en Viale y Turtas (53).
43. Sekhar LN, Goel A: Combined supratentorial and infratentorial approach to large pineal-region meningioma. Surg Neurol 37: 197-201, 1992.
44. Shi-qui L, Deze L, Mozhi Z et al: Occipital transtentonal approach for removal of pineal region tumors: report fo 64 consecutives cases. Surg Neurol 32: 36-39, 1989.
45. Shucart W: Removal of tumors in the third ventricle. En: Neurosurgical procedures: personal approaches to classic operations. Wilson CB. (ed). Williams & Wilkins, Baltimore 1992, pp-52-62.
46. Stein BM: The infratentorial supracerebellar approach to pineal lesions. J Neurosurg 35: 197-202, 1971.
47. Stein BM: Surgical treatment of pineal tumors. Clin Neurosurg 26: 490-510, 1979.
48. Stein BM: Transcallosal approach to tumors of the third ventricle. En Operative Neurosurgical Techniques. Schmidek HH and Sweet WH. (ed). Grune Stratton, Inc 1988, pp 381-386.
49. Suzuki J, Katakura R, Mori T: Interhemispheric approach through the lamina terminalis to tumors of the anterior part of the third ventricle. Surg Neurol 22: 157-163, 1984.
50. Symon L, Sprich W: Radical excision of craniopharyngioma. Results in 20 patients. J Neurosurg 62: 174-181, 1985.
51. Tindall GT, Collins WF, Krichner JA: Unilateral septal technique for transsphenoidal microsurgical approach to the sella turcica. Technical note. J Neurosurg 49: 138-142, 1978.
52. Van Wagenen WP: A surgical approach for the remo-val of certain pineal tumors. Surg Gynecol Obstet 53: 216-220, 1931. Referido en Rhoton y col (37).
53. Viale GL, Turtas S: The subchoroidal approach to the third ventricle, Surg Neurol 14: 71-76, 1980.
54. Winston KR, Cavazzuti V, Antunes T: Absence of neurological and behavioral abnormalities after anterior transcallosal operation for third ventricular lesions. Neurosurgery 4: 386-393, 1979.
55. Yamamoto Y, Rhoton AL Jr, Peace DA: Microsurgery of the Third Ventricle: Part 1, Microsurgical anatomy. Neurosurgery 8: 334-356, 1981.
56. Yasagil MG, Antic J, Laciga R et al: Microsurgical pterional approach to aneurysm of the basilar
bifurcation. Surg Neurol 6: 83-91, 1976,
57. Yasargil MG, Jain KK, Antic J et al: Arteriovenous malformations of the esplenium of the corpus callo-sum: microsurgical treatment. Surg Neurol 5: 5-14, 1976.
58. Yasargil MG: Operative approach, En: Microneurosurgery. Yasargil MG. (ed) Georg Thieme Verlag. Stuttgart 1987. Vol 1, pp 215-233.
59. Yasargil MG, Curcic M, Kis M et al: Total removal of craniopharyngioma. J Neurosurg 73:3-11, 1990.
